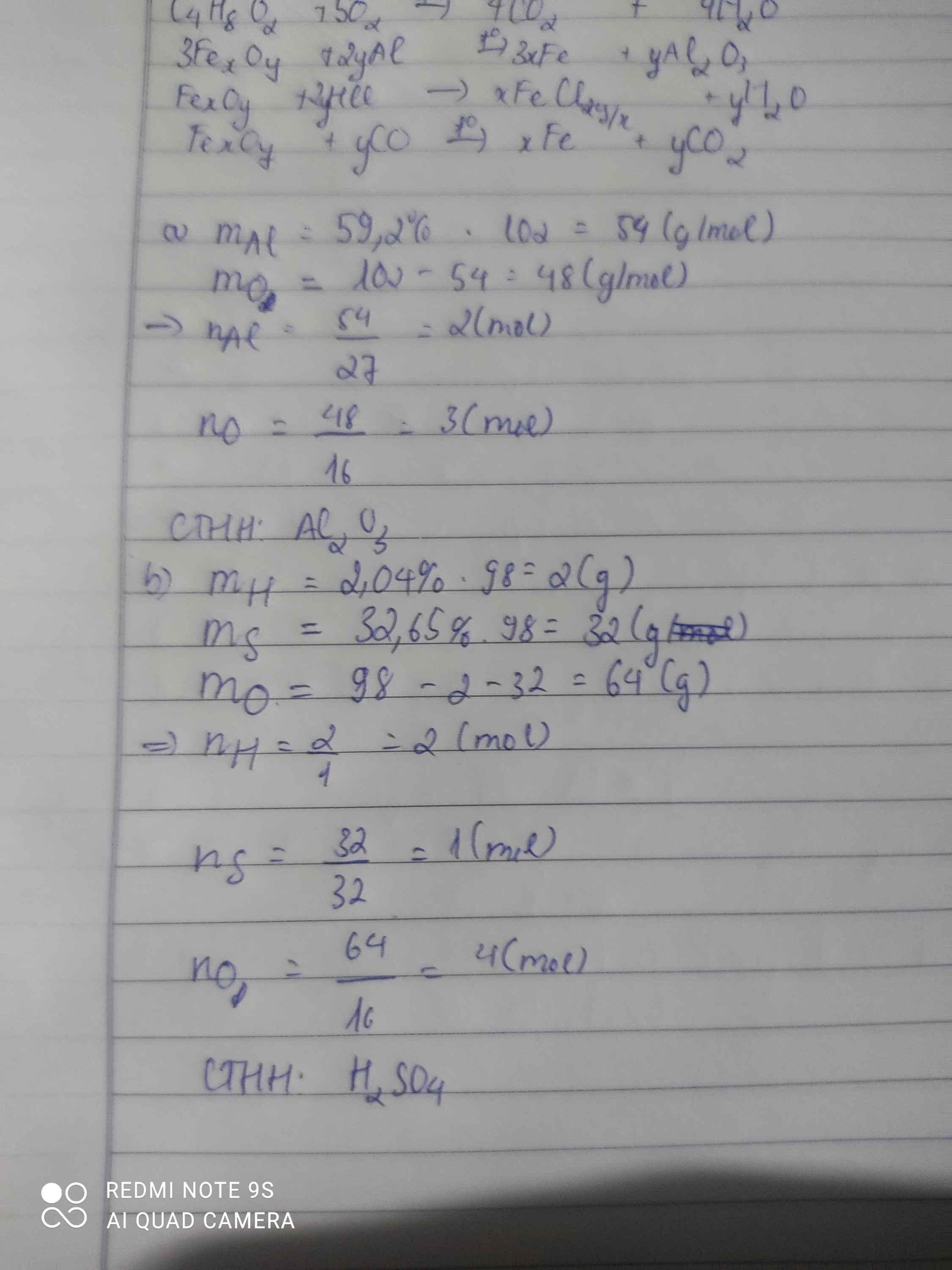Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)

1.Gọi nguyên tố cuối cùng là X
Đặt CTPt là HxCyOzXt
Ta có: x:y:z:t = 1,19/1:14,29/12:57,14/16:27,38/Mx=1:1:3:23/Mx
Vì x,y,z là những số nguyên nên Mx cũng phải là số nguyên
Mặt khác: x+y+z+t < 8 mà x+y+z=8 nên t=23/Mx<3
M>23/3=7,66 lấy M=23,t=1
Công thức của chất là NaHCO3
2.nH2=0,3mol
Gọi x,y lần lượt là số mol của Al và Mg
Ta có: 27x + 24y=6,3(1)
PT: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
x 3/2x
Mg + H2SO4 --> MgSO4 + H2
y y
Ta có:3/2x + y = 0,3(2)
Từ (1)(2) <=> x=0,1 mol y=0,15mol
%Al=2,7.100/6,3=42,85%
%Mg=100% - 42,85%=57,15%
b.Mình chưa được học nên mình chịu nhé :((
c.nH2=0,3mol
Vì H=90% nên số mol H2 phản ứng=0,3.0,9=0,27mol
PT:3H2 + Fe2O3 ---> 2Fe + 3H2O
0,27 0,09 0,18
Theo phương trình:nO bị khử = nH2=0,27mol
Theo phương trình:mFe=0,18.56=10,08g
mA=mFe + mFe2O3 dư=27,68g nên mFe2O3=27,68-10,08=17,6g
Mặt khác theo phương trình ta có:nFe2O3 phản ứng=0,09 mol nên
mFe2O3 phản ứng=0,09.160=14,4g
==> a = 14,4 + 17,6 = 32g
Chúc bạn học tốt nha :>
1.Gọi nguyên tố cuối cùng là X
Đặt CTPt là HxCyOzXt
Ta có: x:y:z:t = 1,19/1:14,29/12:57,14/16:27,38/Mx=1:1:3:23/Mx
Vì x,y,z là những số nguyên nên Mx cũng phải là số nguyên
Mặt khác: x+y+z+t < 8 mà x+y+z=8 nên t=23/Mx<3
M>23/3=7,66 lấy M=23,t=1
Công thức của chất là NaHCO3
2.nH2=0,3mol
Gọi x,y lần lượt là số mol của Al và Mg
Ta có: 27x + 24y=6,3(1)
PT: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
x 3/2x
Mg + H2SO4 --> MgSO4 + H2
y y
Ta có:3/2x + y = 0,3(2)
Từ (1)(2) <=> x=0,1 mol y=0,15mol
%Al=2,7.100/6,3=42,85%
%Mg=100% - 42,85%=57,15%
b.Mình chưa được học nên mình chịu nhé :((
c.nH2=0,3mol
Vì H=90% nên số mol H2 phản ứng=0,3.0,9=0,27mol
PT:3H2 + Fe2O3 ---> 2Fe + 3H2O
0,27 0,09 0,18
Theo phương trình:nO bị khử = nH2=0,27mol
Theo phương trình:mFe=0,18.56=10,08g
mA=mFe + mFe2O3 dư=27,68g nên mFe2O3=27,68-10,08=17,6g
Mặt khác theo phương trình ta có:nFe2O3 phản ứng=0,09 mol nên
mFe2O3 phản ứng=0,09.160=14,4g
==> a = 14,4 + 17,6 = 32g
Chúc bạn học tốt nha :>

bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g

Lập tỉ lệ: x : y : z = 2/24:1/12:4/16= 1/3 ∶ 1/3 ∶1 = 1: 1: 3.
Công thức nguyên (X): ( M g C O 3 ) n
Mà M X = ( 24 + 12 + 48 ) n = 84 → n = 1 → CTHH: M g C O 3
Áp dụng quy tắc hóa trị → Mg có trị II.

Trong 1 mol hợp chất:
$n_H=\dfrac{98.2,04\%}{1}\approx 2(mol)$
$n_S=\dfrac{98.32,65\%}{32}\approx 1(mol)$
$n_O=\dfrac{98-2-32}{16}=4(mol)$
$\to CTHH:H_2SO_4$