Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. hãy viết PTHH của phản ứng giữa metan với oxi :
\(CH4+2O2-^{t0}->CO2\uparrow+2H2O\)
2. hãy chọn từ/cụm từ thích hợp dưới đây để điền vào chỗ trống trong kết luận sau về tính chất hóa học của oxi :
KẾT LUẬN
Khí oxi là 1 đơn chất ..... phi kim rất hoạt động..........(1) , đặc biệt khi ... ở nhiệt độ cao............(2) , dễ dàng tham gia phản ứng hóa học với nhiều phi kim (như ...lưu huỳnh.....(3).cacbon...) , nhiều kim loại (như.đồng ...(3)...sắt...) . Trong các trường hợp chất hóa học , nguyên tố oxi có hóa trị . II...(4)..
CH4+O2 --> t° CO2 +2H2O
1) phi kim rất hoạt động
2) ở nhiệt độ cao
3) lưu huỳnh, photpho,da non
3) sắt, đồng,
3)mentan CH4,propan C3H8,butan C4H10
4)II

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 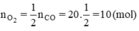
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
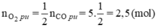 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

a) PTHH:
CuO + H2 =(nhiệt)=> Cu + H2O (1)
Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O (2)
b) - Dựa vào định nghĩa chất khử và chất oxi hóa
=> Chất khử: H2
Chất Oxi hóa: CuO và Fe2O3
c) Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:mCu = 6g - 2,8g = 3,2g.
VH2 cần dùng theo phương trình phản ứng(1) = \(\dfrac{3,2}{64}\cdot64=1,12\left(l\right)\) =
VH2 cần dùng theo phương trình phản ứng(2) = \(\dfrac{2,8}{56}\cdot\dfrac{3}{2}\cdot22,4=1,68\left(l\right)\)
a.Phương trình phản ứng:
CuO + H2 Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b. + Chất khử là H2 vì chiếm oxi của chất khác;
+ Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = = 0,5 (mol)
Số mol sắt là: nFe = = 0,05 (mol)
Thể tích khí H2 cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 (lít)
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là:
nH2 = nFe =
.0,05 = 0,075 mol
=>VH2(đktc) = 22,4.0,075 = 1,68 (lít)

1) \(C+O2-->CO2\)==>Pư hóa hợp
\(2Mg+O2-->2MgO\)==>Pư hóa hợp
\(4Al+3O2-->2Al2O3\)==>Pư hóa hợp
\(C2H6+\frac{7}{2}O2-->2CO2+3H2O\)
\(C2H2+\frac{5}{2}O2-->2CO2+H2O\)
2)
\(3Fe+2O2-->Fe3O4\)
\(S+O2-->SO2\)
\(CH4+2O2-->CO2+2H2O\)
\(2Cu+O2-->2CuO\)
\(4P+5O2-->2P2O5\)
\(C3H8O+\frac{9}{2}O2-->3CO2+4H2O\)
\(C4H10+\frac{13}{2}O2-->4CO2+5H2O\)
\(C7H16+11O2-->7CO2+8H2O\)

a)\(CH4+2O2-->CO2+2H2O\)
\(n_{CH4}=\frac{3,2}{16}=0,2\left(mol\right)\)
\(n_{O2}=2n_{CH4}=0,4\left(mol\right)\)
\(V_{O2}=0,4.22,4=8,96\left(l\right)\)
b)\(n_{CO2}=n_{CH4}=0,2\left(mol\right)\)
\(m_{CO2}=0,2.44=8,8\left(g\right)\)
15: Đốt cháy 4,6 g một hợp chất bằng oxi thu được 8,8g CO2 và 5,4g H2O. Khối lượng oxi đã tham gia phản ứng:
a) 9,6g b) 8,6g c)10g d) 9,8g
16:
\(C3H8+5O2-->3CO2+4H2O\)
Thiếu bài 17
a) C+O2--------->CO2
S+O2------------->SO2
4P+5O2--------->2P2O5
b) 4Na+O2------->2Na2O
2Zn+O2---------->2ZnO
4Al+3O2----->2Al2O3
3Fe+2O2-------->Fe3O4
2Cu+O2--------->2CuO
c)2 CO+O2------>2CO2
2NO+O2--->2NO2
CH4+2O2------>CO2+2H2O
C2H6+7/2O2------>2CO2+3H2O
C3H8+5O2---------->3CO2+4H2O

Bài 1
H2+ 1/2O2 --> H2O
Mg + 1/2O2 --> MgO
Cu+ 1/2O2-->CuO
S+O2 -->SO2
4Al+ 3O2-->2Al2O3
C+ O2--> CO2
2P+5/2O2--> P2O5
Bài 2
CH4+2O2->CO2+2H2O
2C2H2+5O2->4CO2+2H2O
C2H6O+3O2->2CO2+3H2O
a,
\(S+O_2\underrightarrow{^{to}}SO_2\)
\(2Al+3O_2\rightarrow2Al_2O_3\)
\(4K+O_2\rightarrow2K_2O\)
\(C+O_2\underrightarrow{^{to}}CO_2\)
\(2Cu+O_2\rightarrow2CuO\)
\(2Mg+O_2\rightarrow2MgO\)
b,
\(2CH_4+O_2\rightarrow2CO+4H_2\) hoặc \(CH_4+2O_2\rightarrow CO_2+2H_2O\)
\(2C_2H_2+O_2\rightarrow4CO_2+2H_2O\)
\(2C_4H_{10}+5O_2\rightarrow4CH_3COOH+2H_2O\)