Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

(1) 2Ag0 + Cl20 → 2Ag+Cl-
Nguyên tố Ag và Cl thay đổi số oxi hóa.
(2) 2Ag+N5+O32- + Ba2+Cl2- → 2Ag+Cl- + Ba2+(N5+O32-)2
Không có nguyên tố nào thay đổi số oxi hóa.

a) H – O – O – H
Số oxi hóa của H là +1
Gọi x là số oxi hóa của O, theo quy tắc 1 và 2 có:
1.(+1) + 1.x + 1.x + 1.(+1) = 0 → x = -1.
Vậy số oxi hóa của H là +1, của O là -1 (trường hợp đặc biệt).
b) Nguyên tố O gây nên tính oxi hóa của H2O2.
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O(quá trình oxi hóa)
2Fe3+ + H2O2 + 2OH- → 2Fe2+ + 2H2O + O2 (quá trình khử)

\(B1.\overset{0}{Mg}+H_2\overset{+6}{S}O_4\rightarrow\overset{2+}{Mg}SO_4+H_2\overset{2-}{S}+H_2O\\ B2+B3.QToxh:Mg\rightarrow Mg^{2+}+2e|\times4\\ QTkhử:S^{+6}+8e\rightarrow S^{2-}|\times1\\ B4.4Mg+5H_2SO_4\rightarrow4MgSO_4+H_2S+4H_2O\)
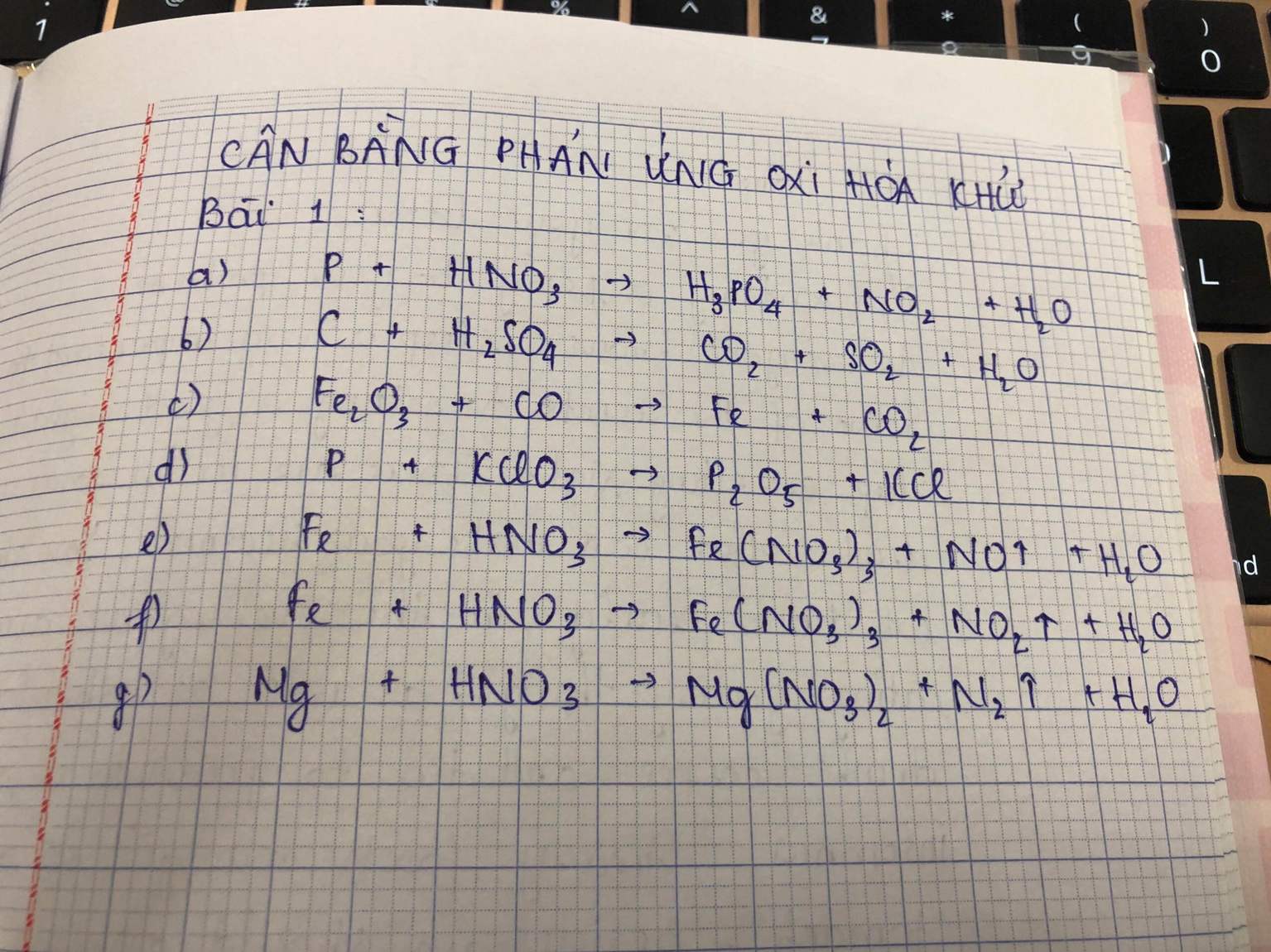
CH4 + 2O2 → CO2 + 2H2O
C-4H4+ + O20 → C4+O22- + H2+O2-
Quá trình thay đổi số oxi hóa
C-4 → C4+ + 8e
O20 + 4e → 2O2-