
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Mendeleev sắp xếp 9 nguyên tố như bảng 6.1 theo nguyên tắc:
- Tăng dần khối lượng nguyên tử từ trái sang phải, từ trên xuống dưới.
- Các nguyên tố trong cùng 1 dãy có tính chất tương tự nhau:
+ Dãy halogen: Cl, Br, I
+ Dãy kim loại kiềm: K, Rb, Cs
+ Dãy kim loại kiềm thổ: Ca, Sr, Ba

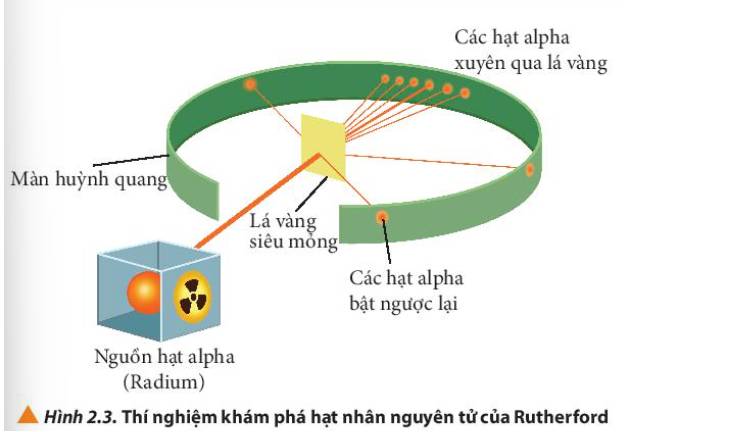
- Quan sát Hình 2.3 thấy được: hầu hết các hạt α đi thẳng, có vài hạt bị bắn theo đường gấp khúc
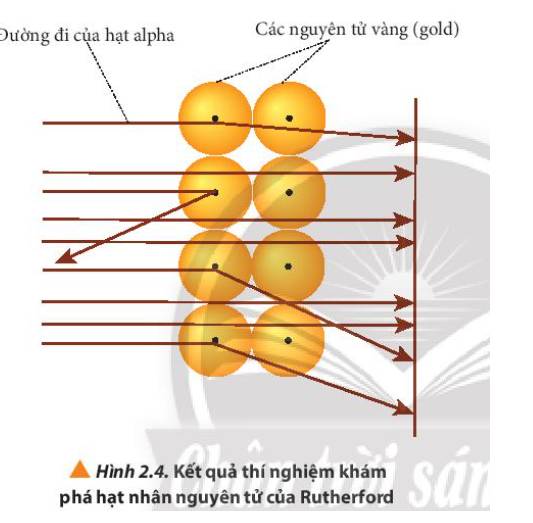
- Quan sát Hình 2.4 giải thích: các hạt α bị bắn theo đường gấp khúc là do va vào hạt nhân của nguyên tử vàng, các hạt không va vào hạt nhân thì đi thẳng
- Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít bị bật ngược lại.
Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.

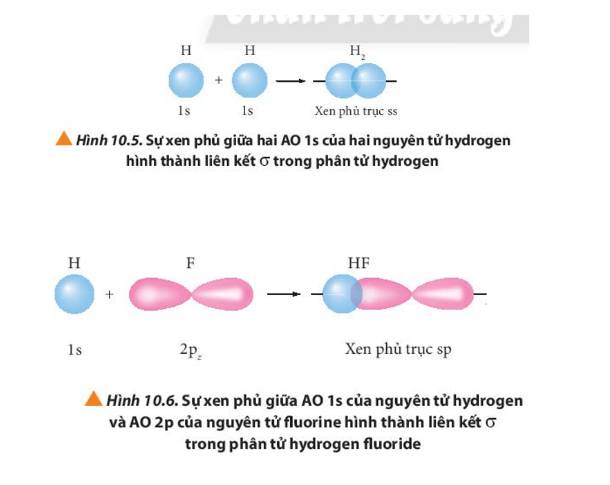
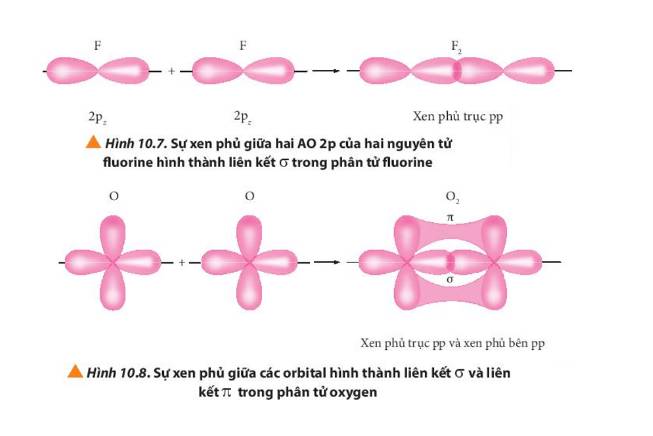
- Liên kết σ trong mỗi phân tử được tạo thành bởi sự xen phủ trục
- Liên kết п trong mỗi phân tử được tạo thành bởi sự xen phủ bên

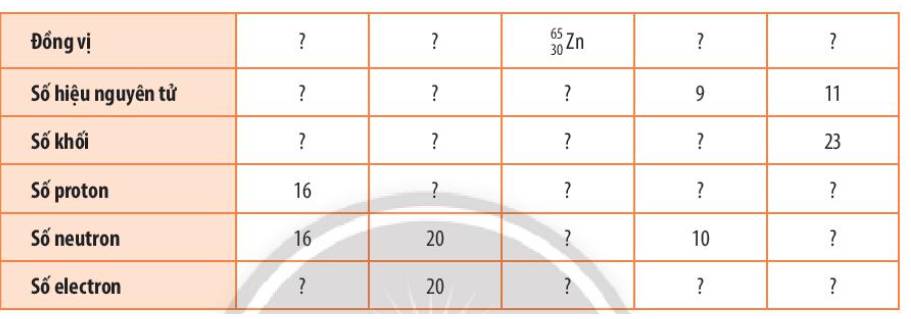
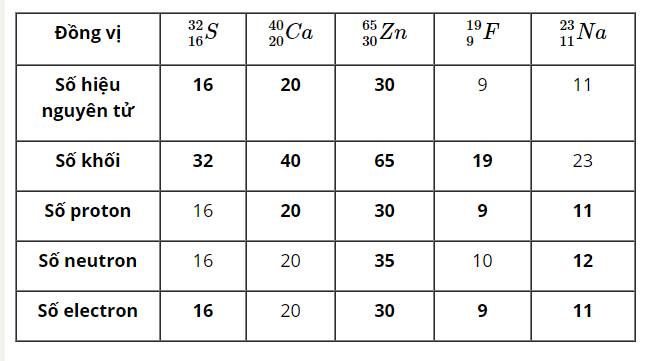
Hàng 1: \(^{32}_{16}S,^{40}_{20}Ca,^{65}_{30}Zn,^{19}_9F,^{23}_{11}Na\)
Hàng 2: 16, 20, 30, 8, 11
Hàng 3: 32, 40, 65, 18, 23
Hàng 4: 16, 20, 30, 9, 11
Hàng 5: 16, 20, 35, 10, 12
Hàng 6: 16,20,30,9,11

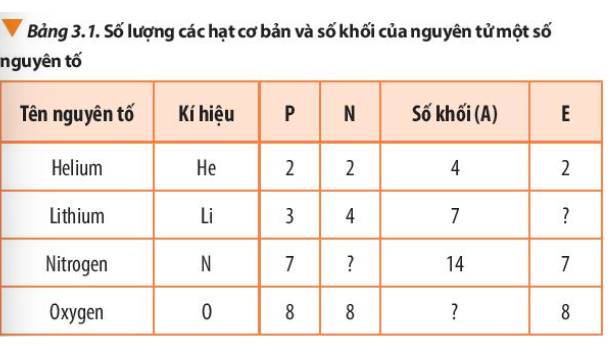
Số khối A = số proton (P) + số neutron (N)
Số electron (E) = Số proton (P)
Tên nguyên tố | Kí hiệu | P | N | Số khối (A) | E |
Helium | He | 2 | 2 | 4 | 2 |
Lithium | Li | 3 | 4 | 7 | 3 |
Nitrogen | N | 7 | 7 | 14 | 7 |
Oxygen | O | 8 | 8 | 16 | 8 |

a) Ảnh hưởng của nồng độ: Dùng bình chứa oxygen có nồng độ oxygen cao hơn không khí => Phản ứng cháy dễ dàng xảy ra
b) Ảnh hưởng của áp suất: Dùng nồi áp suất làm tăng áp suất trong nồi => Thực phẩm trong nồi áp suất sẽ nhanh chín hơn
c) Ảnh hưởng của diện tích tiếp xúc: Đậy nắp lò làm hạn chế diện tích tiếp xúc của than với oxygen trong không khí => Phản ứng cháy diễn ra chậm => Giữ than cháy được lâu hơn
d) Ảnh hưởng của nhiệt độ: Khi để thức ăn trong tủ lạnh => Nhiệt độ bị giảm => Kìm hãm phản ứng oxi hóa thức ăn => Thức ăn sẽ lâu bị ôi thiu
- Hình 16.9a) Ảnh hưởng của nồng độ đến tốc độ phản ứng:
Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ Tăng tốc độ phản ứng cháy
- Hình 16.9b) Ảnh hưởng của áp suất đến tốc độ phản ứng.
Dùng nồi áp suất làm tăng áp suất trong nồi ⇒ tăng tốc độ phản ứng ⇒ Làm thức ăn nhanh chín hơn.
- Hình 16.9c) Ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng.
Đậy nắp lò làm giảm diện tích tiếp xúc của than với oxygen trong không khí ⇒ Giảm tốc độ phản ứng cháy ⇒ Than cháy được lâu hơn.
- Hình 16.9d) Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
Bảo quản thức ăn trong tủ lạnh ⇒ Giảm nhiệt độ ⇒ Giảm tốc độ phản ứng oxi hóa thức ăn ⇒ Thức ăn lâu bị ôi thiu.

Trong tự nhiên, các halogen không tồn tại dưới dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide
Halogen trong tự nhiên không tồn tại ở dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F-, Cl-, Br-, I-)





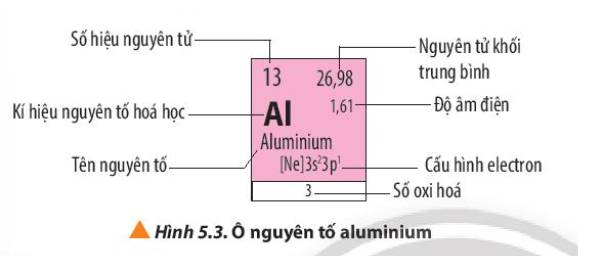

Ô nguyên tố Vanadium cho biết các thông tin sau:
- Kí hiệu hóa học: V
- Tên nguyên tố: Vanadium
- Số hiệu nguyên tử: 23
- Nguyên tử khối trung bình: 50,942