Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH:
CuO + H2 =(nhiệt)=> Cu + H2O (1)
Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O (2)
b) - Dựa vào định nghĩa chất khử và chất oxi hóa
=> Chất khử: H2
Chất Oxi hóa: CuO và Fe2O3
c) Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:mCu = 6g - 2,8g = 3,2g.
VH2 cần dùng theo phương trình phản ứng(1) = \(\dfrac{3,2}{64}\cdot64=1,12\left(l\right)\) =
VH2 cần dùng theo phương trình phản ứng(2) = \(\dfrac{2,8}{56}\cdot\dfrac{3}{2}\cdot22,4=1,68\left(l\right)\)
a.Phương trình phản ứng:
CuO + H2 Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b. + Chất khử là H2 vì chiếm oxi của chất khác;
+ Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = = 0,5 (mol)
Số mol sắt là: nFe = = 0,05 (mol)
Thể tích khí H2 cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 (lít)
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là:
nH2 = nFe =
.0,05 = 0,075 mol
=>VH2(đktc) = 22,4.0,075 = 1,68 (lít)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 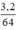 = 0,05 mol
= 0,05 mol
nFe = 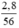 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 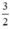 . nFe =
. nFe = 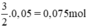 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(\Rightarrow m_{Cu}=6-2,8=3,2g\)\(\Rightarrow n_{Cu}=0,05mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,05 0,05
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,075 0,05
\(\Rightarrow\Sigma n_{H_2}=0,075+0,05=0,125mol\)
\(\Rightarrow V=0,125\cdot22,4=2,8l\)

a) Phương trình phản ứng xảy ra là:
2K + 2H2O → 2KOH + H2.
Ca + 2H2O → Ca(OH)2 + H2.
b) Các phản ứng trên thuộc loại phản ứng oxi hóa – khử.

a) Ta có các phương trình phản ứng sau:
- \(2Na+2H_2O\rightarrow2NaOH+H_2\) (1)
- \(2K+2H_2O\rightarrow2KOH+H_2\) (2)
- \(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\) (3)
b) Các loại phản ứng trên thước loại phản ứng thế vì nó là sự kết hợp giữa một đơn chất ( Na, K, Ca) với một hợp chất (\(H_2O\)); nguyện tử của đơn chất chiếm lấy chỗ của nguyên tử của một nguyên tố khác trong hợp chất. ( phương trình (1) nguyên tử của nguyên tố Na đã thay thế cho nguyên tử của nguyên tố Hiđrô trong hợp chất \(H_2O\); tương tự các phương trình (2) và (3) các nguyên tử của các nguyên tố K, Ca đã thay thế cho nguyên tử của nguyên tố Hiđrô trong hợp chất \(H_2O\).

a/ 2Al + 3S -to-> Al2S3
b/ Fe + S -to-> FeS
c/ Pb + S -to-> PbS
d/ 2Na + S -to-> Na2S
a/ 2Al + 3S -to-> Al2S3
b/ Fe + S -to-> FeS
c/ Pb + S -to-> PbS
d/ 2Na + S -to-> Na2S

$\bullet$ Các kim loại phản ứng với nước ở điều kiện thường: `Ca` , `Na` , `K` , `Li`
$\bullet$ Phương trình phản ứng:
`Ca+H_2O->Ca(OH)_2+H_2`
`Na+H_2O->NaOH+H_2`
`K+H_2O->KOH+H_2`
`Li+H_2O->LiOH+H_2`
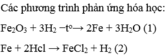
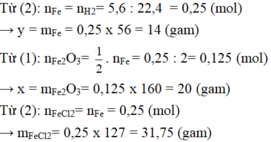
1)
2Al + 6HCl --> 2AlCl3 + 3H2
Pb + 2HCl --> PbCl2\(\downarrow\) + H2
Zn + 2HCl --> ZnCl2 + H2
Cu không phản ứng
2)
- Từ các thí nghiệm, ta thu được kết quả:
+ Al có thể tác dụng với HCl rất loãng, sinh ra muối AlCl3 và có khí H2 thoát ra.
+ Zn có thể tác dụng với HCl loãng, sinh ra muối ZnCl2 và có khí H2 thoát ra.
+ Pb tác dụng với dd HCl tạo ra PbCl2 không tan bám vào bề mặt kim loại khiến phản ứng nhanh chóng dừng lại, lượng khí H2 thoát ra không đáng kể.
+ Cu không tác dụng với HCl
=> Kim loại được sắp xếp theo chiều từ mạnh đến yếu: Al, Zn, Pb, Cu
sắp xếp là :Al->Zn->Pb->Cu
=> sắp xếp theo tính khử