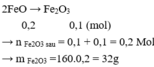Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
![]()
(II).Sai. Nguyên tắc điều chế Cl2 là OXH ion Cl-
(III). Sai.Điều chế oxi người ta điện phân H2O việc cho thêm (NaOH,H2SO4) vào chỉ để làm mồi đồng thời tăng khả năng dẫn điện.
(IV). Sai.Là hai dạng thù hình của nhau.
(V). Sai.HF không có tính khử mạnh.
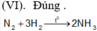
![]()
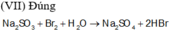

a, - Hiện tượng: Sau khi cho nước vào thấy có hơi màu tím thoát ra.
- Giải thích: Sau khi thêm nước, phản ứng giữa Al và I2 xảy ra, tỏa nhiệt mạnh là I2 thăng hoa.
b, PT: \(2Al+3I_2\underrightarrow{^{H_2O}}2AlI_3\)
Vai trò chất tham gia: Al là chất khử, I2 là chất oxy hóa, H2O là xúc tác.
c, - Do iot có độ âm điện nhỏ, bán kính nguyên tử lớn nên COI2 kém bền → không tồn tại.

1) Dùng để sản xuất thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ, ...
2) Các công đoạn sản xuất H2SO4:
- Sản xuất SO2 (Đốt cháy lưu huỳnh/đốt quặng pirit sắt)
- Sản xuất SO3 (Oxi hóa SO2 bằng oxi/không khí dưở 450-500oC, xúc tác V2O5)
- Hấp thụ SO3 bằng H2SO4 (Dùng H2SO4 98% hấp thụ SO3 được oleum, dùng lượng nước thích hợp để pha loãng oleum)
3)
- Gồm 2 loại:
+ Muối trung hòa (muối sunfat): chứa ion SO42-
+ Muối axit (muối hidrosunfat): chứa ion HSO4-
4)
- Thường dùng dd muối bari hoặc dd Ba(OH)2

Các chất có thể đóng vai trò chất oxi hoá là S, SO 2 , H 2 SO 3 . Thí dụ
a) S + 2Na → Na 2 S
b) SO 2 + 2 H 2 S → 3S + 2 H 2 O
c) H 2 SO 3 + 2 H 2 S → t ° 3S + 3 H 2 O
Các chất có thể đóng vai trò chất khử là S, H 2 S , SO 2 , H 2 SO 3 . Thí dụ
a) S + O 2 → t ° SO 2
b) H 2 S + Cl 2 → S + 2HCl
c) SO 2 + Br 2 + 2 H 2 O → H 2 SO 4 + 2HBr
d) 5 H 2 SO 3 + 2 KMnO 4 → 2 H 2 SO 4 + K 2 SO 4 + 2Mn SO 4 + 3 H 2 O

- Chất tẩy rửa phổ biến là nước Javel gồm có NaCl và NaClO
=> Hai chất tác dụng với nhau để tạo thành nước Javel là: NaOH và Cl2
- Vì A ở dạng dung dịch, Y ở dạng khí
=> A là dung dịch NaOH, Y là khí Cl2
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
- Mà Y là khí Cl2
=> X là khí H2
a) Công thức hóa học của A, X, Y lần lượt là: NaOH, H2, Cl2
b) Phương trình hóa học
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g) (*)

\(a) Mg + H_2SO_4 \to MgSO_4 + H_2\\ n_{Mg} = n_{H_2} = \dfrac{1,12}{22,4} =0,05(mol)\\ m_{Mg} = 0,05.24 =1,2(gam)\\ m_{Cu} = 7,6 -1,2 = 6,4(gam)\\ b) n_{H_2SO_4} = n_{H_2} = 0,05(mol) \Rightarrow V_{dd\ H_2SO_4} = \dfrac{0,05}{0,5} =0,1(lít)\\ c) n_{MgSO_4} = n_{H_2} = 0,05(mol) \Rightarrow m_{MgSO_4} = 0,05.120 = 6(gam)\\ d) \text{Bảo toàn electron: } 2n_{Mg} + 2n_{Cu} = 2n_{SO_2}\\ \Rightarrow n_{SO_2} = 0,05 + \dfrac{6,4}{64} = 0,15(mol) \Rightarrow V_{SO_2} = 0,15.22,4 = 3,36(lít)\)