Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{SO_2}=0.2\left(mol\right)\)
Bảo toàn e :
\(n_{Cu}=n_{SO_2}=0.2\left(mol\right)\)
\(m_{Cu}=0.2\cdot64=12.8\left(g\right)\)
\(m_{Mg}+m_{Al}=24x+27y=33.2-12.8=20.4\left(g\right)\left(1\right)\)
\(n_{H_2}=x+1.5y=1\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.4\)
\(m_{Mg}=0.4\cdot24=9.6\left(g\right)\)
\(m_{Al}=10.8\left(g\right)\)
=> C

Đáp án C
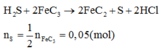
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.


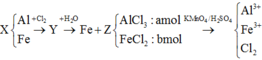
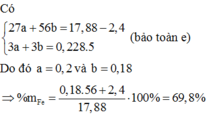
A. S
sự trở lại của Võ Quang Nhân :D