
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. PT chữ: Magie + Axit clohidric ---> Magie clorua + khí hidro
Phương trình khối lượng:
\(m_{magie\left(p.ứ\right)}+m_{axit.clohidric}=m_{magie.clorua}+m_{khí.hidro}\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b. Biểu thức khối lượng cho biết lượng Magie còn dư:
\(\left[m_{Mg\left(bđ\right)}-m_{Mg\left(dư\right)}\right]+m_{HCl}=m_{MgCl_2}+m_{H_2}\\\Leftrightarrow\left[5-m_{Mg\left(dư\right)}\right]+14,6=19+0,4\\ \Leftrightarrow m_{Mg\left(dư\right)}=0,2\left(g\right) \)
c) \(m_{Mg\left(p.ứ\right)}=5-0,2=4,8\left(g\right)\)
\(\)

| CTHH | Phân loại | Gọi tên |
| KNO3 | Muối | Kali nitrat |
| BaO | Oxit | Bari oxit |
| FeCl3 | Muối | Sắt (III) clorua |
| Ca(OH)2 | Bazơ | Canxi hiđroxit |
| Pb(OH)2 | Bazơ | Chì (II) hiđroxit |
| CO2 | Oxit | Cacbon đioxit |
| NO | Oxit | Nitơ oxit |
| Al2O3 | Oxit | Nhôm oxit |
| H3PO4 | Axit | Axit photphoric |
| HCl | Axit | Axit clohiđric |
| CO | Oxit | Cacbon oxit |
| HNO3 | Axit | Axit nitric |
| MgO | Oxit | Magie oxit |
| Fe3O4 | Oxit | Sắt từ oxit |
| H2CO3 | Axit | Axit cacbonic |
| Fe(OH)2 | Bazơ | Sắt (III) hiđroxit |

a) nAl= 0,2(mol)
PTHH: 4Al + 3 O2 -to-> 2 Al2O3
nO2= 3/4 . 0,2= 0,15(mol)
=>V(O2,đktc)=0,15.22,4=3,36(l)
Vkk(đktc)=5.V(O2,đktc)=3,36.5=16,8(l)
b) nAl=0,2(mol)
nO2=0,4(mol)
Ta có: 0,2/4 < 0,4/3
=> Al hết, O2 dư, tính theo nAl.
- Sau phản ứng có O2(dư) và Al2O3
nAl2O3= nAl/2= 0,2/2=0,1(mol)
nO2(dư)= 0,4- 0,2. 3/4=0,25(mol)

Bài 1
CaCO3 \(\xrightarrow[]{t^o}\) CaO + CO2(1)
CO2 + 2NaOH \(\rightarrow\) Na2CO3 + H2O (2)
nCaCO3 = \(\dfrac{20}{100}=0,2mol\)
Theo pt (1) nCO2 = nCaCO3 = 0,2 mol
Theo pt (2) nNa2CO3 = nCO2 = 0,2mol
=> mNa2CO3 = 0,2.106 = 21,2g
Bài 1
CaCO3 CaO + CO2(1)
CO2 + 2NaOH Na2CO3 + H2O (2)
nCaCO3 =
Theo pt (1) nCO2 = nCaCO3 = 0,2 mol
nNaOH = 11,2 : 40 = 0,28 mol
Lập tỉ lệ : \(nCO_2:nNaOH=\dfrac{0,2}{1}:\dfrac{0,28}{2}=0,2:0,14\)
=> CO2 dư
nNa2CO3 = 1/2 n NaOH = 0,14mol
=> mNa2CO3 = 0,14.106 = 14,84g
Sửa lại xíu nha

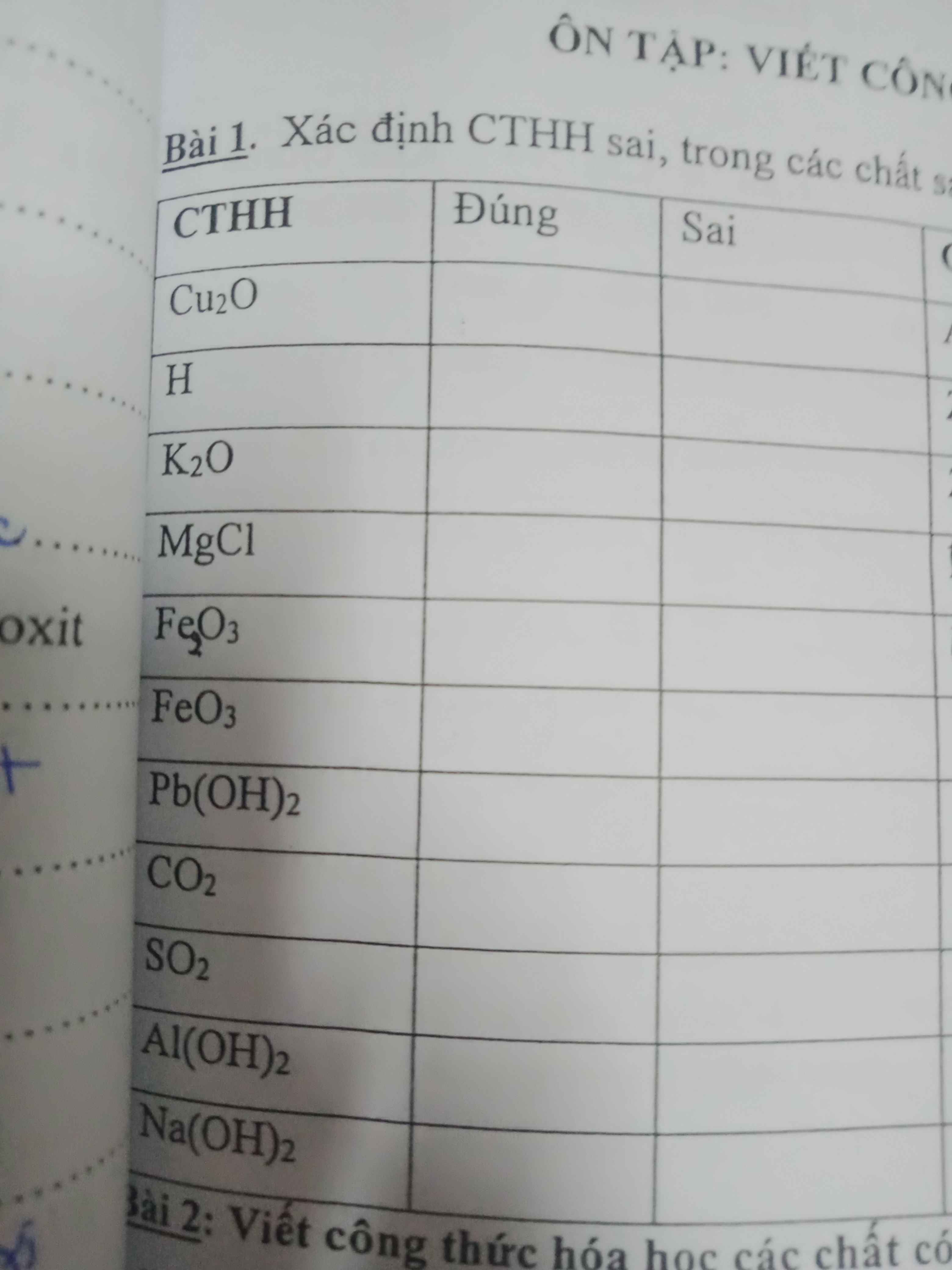
Bài 1:
\(1.Cu_2O:Đúng\)
\(2.H:Sai\Rightarrow Sửa:H_2\)
\(3.K_2O:Đúng\)
\(4.MgCl:Sai\Rightarrow Sửa:MgCl_2\)
\(5.Fe_2O_3:Đúng\)
\(6.FeO_3:Sai\Rightarrow Sửa:Fe_2O_3\)
\(7.Pb\left(OH\right)_2:Đúng\)
\(8.CO_2:Đúng\)
\(9.SO_2:Đúng\)
\(10.Al\left(OH\right)_2:Sai\Rightarrow Sửa:Al\left(OH\right)_3\)
\(11.Na\left(OH\right)_2:Sai\Rightarrow Sửa:NaOH\)

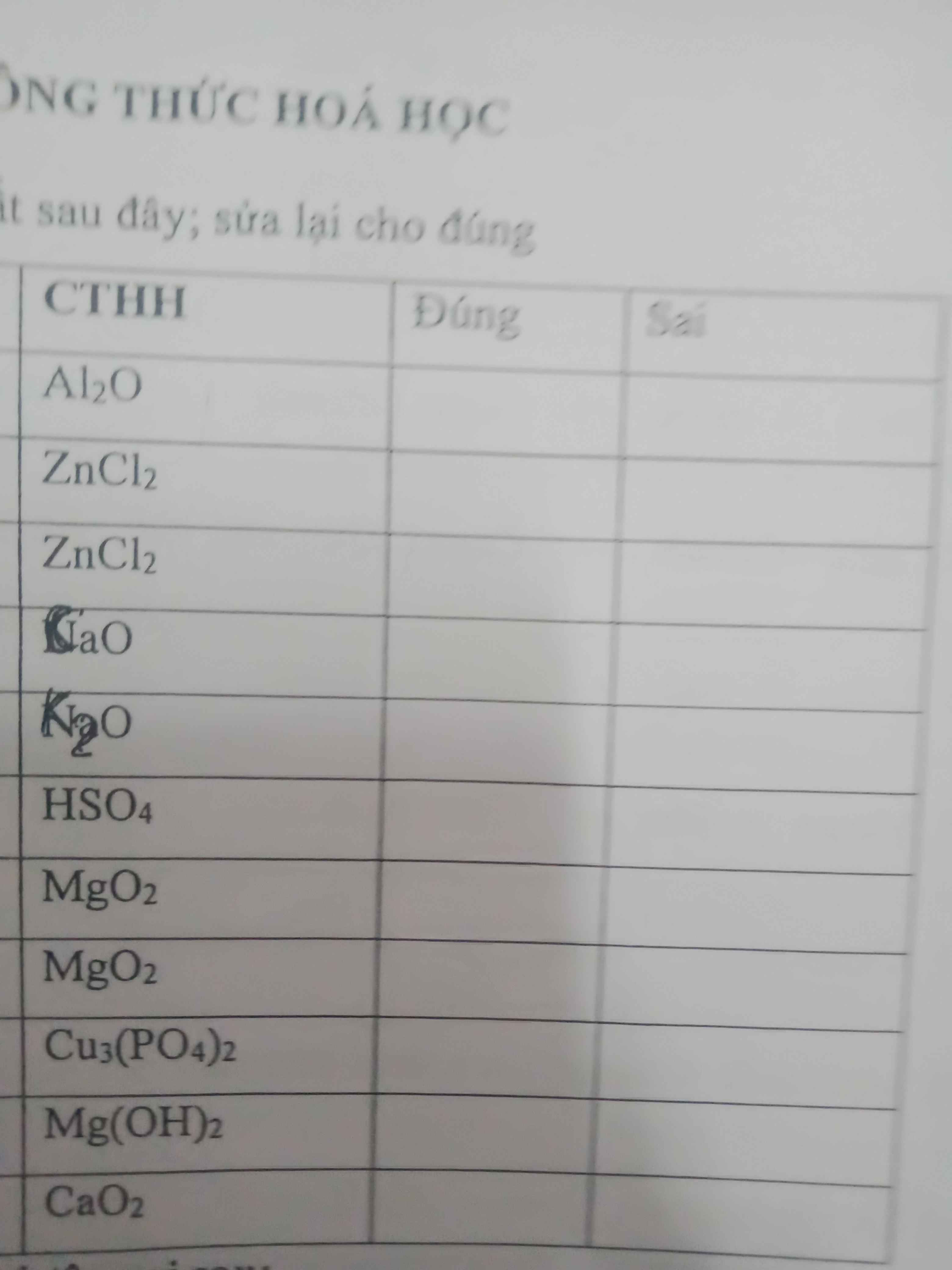
\(1.Al_2O:Sai\Rightarrow Al_2O_3\)
\(2.ZnCl_2:Đúng\)
\(3.CaO:Đúng\)
\(4.K_2O:Đúng\)
\(5.HSO_4:Sai\Rightarrow H_2SO_4\)
\(6.MgO_2:Sai\Rightarrow MgO\)
\(7.Cu_3\left(PO_4\right)_2:Đúng\)
\(8.Mg\left(OH\right)_2:Đúng\)
\(9.CaO_2:Sai\Rightarrow CaO\)

\(1.Zn+\dfrac{1}{2}O_2-^{t^o}\rightarrow ZnO\)
\(2.Ba+\dfrac{1}{2}O_2\rightarrow BaO\)
\(3.Mg+\dfrac{1}{2}O_2-^{t^o}\rightarrow MgO\)
\(4.C+O_2-^{t^o}\rightarrow CO_2\)
\(5.2P+\dfrac{5}{2}O_2-^{t^o}\rightarrow P_2O_5\)
\(6.2Na+\dfrac{1}{2}O_2-^{t^o}\rightarrow Na_2O\)
\(7.2K+\dfrac{1}{2}O_2-^{t^o}\rightarrow K_2O\)
\(8.2Al+\dfrac{3}{2}O_2-^{t^o}\rightarrow Al_2O_3\)
a. 2Zn + O2 ---to---> 2ZnO
b. 2Mg + O2 ---> 2MgO
c. 4P + 5O2 ---> 2P2O5
d. 4K + O2 ---to---> 2K2O
e. 2Ba + O2 ---> 2BaO
f. C + O2 ---> CO2
g. 4Na + O2 ---> 2Na2O
h. 4Al + 3O2 ---to---> 2Al2O3.








a. PT chữ: Khí hidro + Khí oxi --to---> Nước
Biểu thức về khối lượng của phản ứng:
\(m_{khí.hidro}+m_{khí.oxi.p.ứ}=m_{nước}\)
\(PTHH:2H_2+O_2\underrightarrow{t^o}2H_2O\)
b. Biểu thức về KL oxi còn dư:
\(m_{H_2}+m_{O_2\left(bđ\right)}=m_{H_2O}+m_{O_2\left(dư\right)}\)
c. KL oxi p.ứng:
\(m_{O_2\left(p.ứ\right)}=m_{H_2O}-m_{H_2}=9-1=8\left(g\right)\)
d. KL oxi còn dư:
\(m_{O_2\left(dư\right)}=m_{O_2\left(bđ\right)}-m_{O_2\left(p.ứ\right)}=10-8=2\left(g\right)\)