Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A.
Quá trình biến đổi là đẳng tích, ta có:
![]()
Với p1 = 40 atm; p2 = p1 + 10 = 50 atm; T1 = t1 + 273 = 27 + 273 = 300 K.
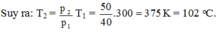

Chọn A.

Ở điều kiện tiêu chuẩn (1 atm, 0 o C ), khối lượng riêng của ôxi là: p 0 = m / V 0
Ở điều kiện 150 atm, 0 o C , khối lượng riêng của ôxi là: ρ = m/V.
Do đó: m = p 0 . V 0 = ρ.V (1)
Do nhiệt độ không đổi, theo định luật Bôi-lơ – Ma-ri-ốt: p 0 . V 0 = pV (2)
Từ (1) và (2) suy ra:
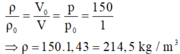
Và m = ρ . V = 214,5.15.10 − 3 ≈ 3,22 k g

Chọn A.

Ở điều kiện tiêu chuẩn (1 atm, 0 o C ), khối lượng riêng của ôxi là: p 0 = m/ V 0 .
Ở điều kiện 150 atm, 0 o C , khối lượng riêng của ôxi là: ρ = m/V.
Do đó: m = p 0 V 0 = ρ.V (1)
Do nhiệt độ không đổi, theo định luật Bôi-lơ – Ma-ri-ốt: p 0 V 0 = pV (2)
Từ (1) và (2) suy ra:
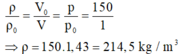
Và m = ρ . V = 214,5.15.10 − 3 ≈ 3,22 k g

Chọn A.
Ở điều kiện tiêu chuẩn (1 atm, 0 oC), khối lượng riêng của ôxi là: ρ0 = m/V0.
Ở điều kiện 150 atm, 0 oC, khối lượng riêng của ôxi là: ρ = m/V.
Do đó: m = ρ0.V0 = ρ.V (1)
Do nhiệt độ không đổi, theo định luật Bôi-lơ – Ma-ri-ốt: p0V0 = pV (2)
Từ (1) và (2) suy ra:
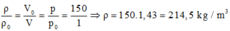
Và m = ρ.V = 214,5.15-3 ≈ 3,23 kg.

Chọn B.
Xét lượng khí còn lại trong bình:
Trạng thái 1: V1 = V/2; T1 = 300 K; p1 = 30 atm.
Trạng thái 2: V2 = V; T2 = 283 K; p2 = ?
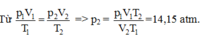

Chọn A.
Thể tích của bóng thám không được xác định bằng công thức: V = 4πR3/3.
Từ phương trình trạng thái ta được:
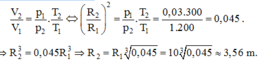
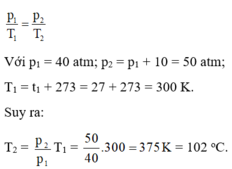
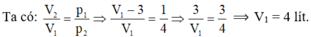
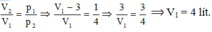
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow p_2=\dfrac{p_1T_2}{T_1}=\dfrac{1.\left(273+273\right)}{273}=2atm\)
Đáp án: A