Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

X gồm \(\left\{{}\begin{matrix}CO:a\left(mol\right)\\H_2:b\left(mol\right)\\CO_2:c\left(mol\right)\end{matrix}\right.\)
=> a + b + c = 0,9 (1)
Bảo toàn H: \(n_{H_2O\left(bđ\right)}=b\left(mol\right)\)
Bảo toàn O: \(n_{CO_2\left(bđ\right)}=\dfrac{a+2c-b}{2}\left(mol\right)\)
=> \(\dfrac{a+2c-b}{2}+b=0,7\)
=> a + b + 2c = 1,4 (2)
(2) - (1) => c = 0,5 (mol)
nNaOH = 0,2.2 = 0,4 (mol)
Xét tỉ lệ: \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,4}{0,5}=0,8\) => Tạo muối NaHCO3
nHCl = 0,25.1 = 0,25 (mol)
PTHH: NaOH + CO2 --> NaHCO3
0,4-------------->0,4
NaHCO3 + HCl --> NaCl + CO2 + H2O
Xét tỉ lệ \(\dfrac{0,4}{1}>\dfrac{0,25}{1}\) => HCl hết
NaHCO3 + HCl --> NaCl + CO2 + H2O
0,25--------->0,25
=> V = 0,25.22,4 = 5,6 (l)

n C O 2 = 11 , 2 22 , 4 = 0 , 5 m o l
Na2O + H2O → 2NaOH (1)
BaO + H2O → Ba(OH)2 (2)
Dd X thu được chứa: Ba(OH)2 và NaOH
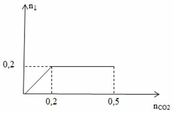
Khi sục từ từ CO2 vào dd Y ta thu được kết tủa như đồ thị hình vẽ.
Từ đồ thị ta thấy có 2 giai đoạn:
+ giai đoạn 1: đồ thị đi lên do xảy ra phản ứng:
CO2 + Ba(OH)2 → BaCO3 ↓+ H2O (3)
0,2 ← 0,2 ← 0,2 (mol)
nBaCO3 max = 0,2 (mol) => nBa(OH)2 = nBaCO3 max = 0,2 (mol)
+ giai đoạn 2: đồ thị nằm ngang, lượng kết tủa không thay đổi do xảy ra 2 phản ứng
CO2 + 2NaOH → Na2CO3 + H2O (4)
x → 2x → x (mol)
CO2 + Na2CO3 + H2O → 2NaHCO3 (5)
y → y → 2y (mol)
BTNT C: ∑ nCO2 (1,2,3) = 0,2 + x + y = 0,5
=> x + y = 0,3 (mol) (**)
Dd Y chỉ chứa 2 muối gồm: và Na2CO3 : (x-y) (mol); NaHCO3 : 2y (mol) ( do đồ thị vẫn đi ngang)
Cho từ từ dd Y + 0,3 mol HCl → 0,225 mol CO2 xảy ra phương trình sau:
Na2CO3 + HCl → NaHCO3 + NaCl (6)
(x-y) → (x – y) (mol)
NaHCO3 +HCl → NaCl + CO2↑ + H2O (7)
0,225 ← 0,225 ← 0,225 (mol)
∑ nHCl (6,7) = x – y + 0,0225 = 0,3
=> x – y = 0,075 (**)
Từ (*) và (**) => x = 0,1875 và y = 0,1125 (mol)
BTNT Na: nNa2O = nNa2CO3 + ½ nNaHCO3 = 0,075 + 0,1125 = 0,1875 (mol)
m = mBaO + mNa2O = 0,2. 153 + 0,1875.62 = 42,225 (g)

Gọi $n_{Na_2CO_3\ pư} = 0,1a(mol) ; n_{NaHCO_3\ pư} = 0,3a(mol)$
$Na_2CO_3 + H_2SO_4 \to Na_2SO_4 + CO_2 + H_2O$
$2NaHCO_3 + H_2SO_4 \to Na_2SO_4 + 2CO_2 + 2H_2O$
Theo PTHH :
$n_{H_2SO_4} = 0,1a + 0,3a.0,5 = 0,15 \Rightarrow a = 0,6$
$n_{CO_2} = 0,1a + 0,3a = 0,24(mol)$
Bảo toàn C :
$n_{BaCO_3} = 0,1 + 0,3 - 0,24 = 0,16(mol)$
Bảo toàn S :
$n_{BaSO_4} = n_{H_2SO_4} = 0,15(mol)$
Suy ra :
$m_{ktua} = 0,16.197 + 0,15.233 = 66,47(gam)$

nHCl = 0,3.0,5 = 0,15 (mol) ; nCO2= 1,12 :22,4 = 0,05 (mol)
Khi nhỏ từ từ dd HCl vào dung dịch hỗn hợp NaHCO3 và Na2CO3 sẽ xảy ra phản ứng theo thứ tự:
HCl + Na2CO3 → NaHCO3 + NaCl (1)
HCl + NaHCO3 → CO2 + H2O (2)
Vì dung dịch X sau phản ứng + Ca(OH)2 dư thu được 20 gam kết tủa nữa => trong dd X có chứa NaHCO3 dư => HCl phản ứng hết
2NaHCO3 + Ca(OH)2 dư → CaCO3 + Na2CO3 + H2O (3)
0,4 ← 0,2 (mol)
nCaCO3 = 20 :100 = 0,2 (mol)
Từ PTHH (3) => nNaHCO3 dư = 2nCaCO3 = 0,4 (mol)
HCl+ Na2CO3 → NaHCO3 + NaCl (1)
(0,15 – 0,05) → 0,1 → 0,1 (mol)
HCl + NaHCO3 → CO2 + H2O (2)
0,05 ← 0,05 ← 0,05 (mol)
Từ PTHH (2): nHCl(2) = nNaHCO3(2) = nCO2 = 0,05 (mol)
=> nHCl(1) = ∑ nHCl – nHCl(2) = 0,15 – 0,05 = 0,1 (mol)
Từ PTHH (1): nNa2CO3 = nHCl = 0,1 (mol)
nNaHCO3(1) = nHCl(1) = 0,1 (mol)
Ta có: nNaHCO3(1) + nNaHCO3 bđ = nNaHCO3(2) + nNaHCO3 dư
=> nNaHCO3 bđ = 0,05 + 0,4 – 0,1 = 0,35 (mol)
=> a = mNa2CO3 + mNaHCO3 bđ = 0,1.106 + 0,35.84 = 40 (g)

Pt:
HCl + KOH → KCl + H2O
0,2 → 0,2
Dư: 0,05
2HCl + K2CO3 → 2KCl + CO2↑ + H2O
0,05→ 0,025 0,025
=> CM của KOH và K2CO3 lần lượt là: 1M và 0,125M

Gọi kim loại kiềm và kim loại kiềm thổ là A, B
\(\left\{{}\begin{matrix}n_A=a\left(mol\right)\\n_B=b\left(mol\right)\end{matrix}\right.\)
=> a.MA + b.MB = 42,6 (*)
Và \(\dfrac{a}{b}=\dfrac{5}{4}\Rightarrow b=0,8a\)
\(n_{H_2}=\dfrac{17,472}{22,4}=0,78\left(mol\right)\)
\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
Do \(n_{HCl}< 2.n_{H_2}\) => HCl pư hết, có phản ứng của kim loại với H2O
PTHH: 2A + 2HCl --> 2ACl + H2 (1)
B + 2HCl --> BCl2 + H2 (2)
2A + 2H2O --> 2AOH + H2 (3)
B + 2H2O --> B(OH)2 + H2 (4)
(1)(3) => \(n_{H_2}=\dfrac{1}{2}.n_A=0,5a\left(mol\right)\)
(2)(4) => \(n_{H_2}=n_B=0,8a\left(mol\right)\)
=> \(0,5a+0,8a=0,78\Rightarrow a=0,6\left(mol\right)\Rightarrow b=0,48\left(mol\right)\)
(*) => 0,6.MA + 0,48.MB = 42,6
=> MA + 0,8.MB = 71
=> Chọn \(\left\{{}\begin{matrix}M_A=39\left(K\right)\\M_B=40\left(Ca\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}n_{Ca}=0,48\left(mol\right)\\n_K=0,6\left(mol\right)\end{matrix}\right.\)
Y chứa \(\left\{{}\begin{matrix}n_{Ca^{2+}}=0,48\left(mol\right)\\n_{K^+}=0,6\left(mol\right)\\n_{Cl^-}=0,5\left(mol\right)\\n_{OH^-}=x\left(mol\right)\end{matrix}\right.\)
Bảo toàn điện tích: 2.0,48 + 0,6 = 0,5 + x
=> x = 1,06
- TH1:
2OH- + CO2 --> CO32- + H2O
0,48<----0,48
CO32- + Ca2+ --> CaCO3
0,48<--0,48
=> nCO2 = 0,48 (mol)
- TH2:
2OH- + CO2 --> CO32- + H2O
1,06-->0,53---->0,53
CO32- + Ca2+ --> CaCO3
0,48<--0,48
CO32- + CO2 + H2O --> 2HCO3-
0,05-->0,05
=> nCO2 = 0,58 (mol)
=> \(0,48\le n_{CO_2}\le0,58\)
=> \(10,752\le V_{CO_2}\le12,992\)
nếu k dùng pt ion bn có thể lm nnay
Ca + 2HCl --> CaCl2 + H2
a-->2a-------->a
2K + 2HCl --> 2KCl + H2
b----->b-------->b
2K + 2H2O --> 2KOH + H2
c---------------->c
Ca + 2H2O --> Ca(OH)2 + H2
d------------------->d
=> \(\left\{{}\begin{matrix}a+d=0,48\\b+c=0,6\\2a+b=0,5\end{matrix}\right.\) => 2d + c = 1,06
TH1:
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
d------->d----------->d
2KOH + CO2 --> K2CO3 + H2O
2a---->a-------->a
K2CO3 + CaCl2 --> CaCO3 + 2KCl
a<-------a----------->a
Điều kiện: \(2a\le c\)
<=> \(2a-c\le0\)
<=> \(2\left(0,48-d\right)-\left(1,06-2d\right)\le0\)
<=> \(0\le0,1\) (luôn đúng)
Vậy nkt max = a + d = 0,48 <=> nCO2 min = a + d = 0,48 (mol)
<=> VCO2 min = 10,752(l) (1)
TH2:
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
d------->d----------->d
2KOH + CO2 --> K2CO3 + H2O
c---->0,5c------>0,5c
K2CO3 + CaCl2 --> CaCO3 + 2KCl
a<-------a----------->a
K2CO3 + CO2 + H2O --> 2KHCO3
(0,5c-a)->(0,5c-a)
Điều kiện: \(0,5c\ge a\) (cmt)
Vậy nkt max = a + d = 0,48 <=> nCO2 max = c+d-a = 0,58 (mol)
<=> VCO2 max = 12,992(l) (2)
(1)(2) => ...

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
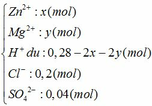
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
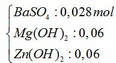
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

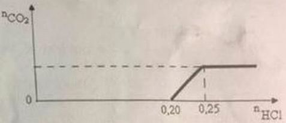
giải thích ra hộ mình nha
\(n_{HCl}=0.3\left(mol\right)\)
\(n_{K_2CO_3}=0.12\cdot0.6=0.072\left(mol\right)\)
\(n_{NaHCO_3}=0.12\left(mol\right)\)
\(K_2CO_3+HCl\rightarrow KHCO_3+KCl\)
\(0.072......0.072..........0.072\)
\(KHCO_3+HCl\rightarrow KCl+CO_2+H_2O\)
\(0.072.......0.072.....................0.072\)
\(n_{HCl\left(cl\right)}=0.3-0.072-0.072=0.156\left(mol\right)\)
\(NaHCO_3+HCl\rightarrow NaCl+CO_2+H_2O\)
\(0.12............0.12..................0.12\)
\(\Rightarrow HCldư\)
\(n_{CO_2}=0.12+0.072=0.192\left(mol\right)\)