Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

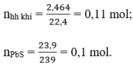
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

Vì khí cho hỗn hợp khí vào dung dịch Pb(NO3)2 thì có kết tủa đen
⇒ Hỗn hợp khí có H2S và H2
Có nPbS = 23,9/239 = 0,1 mol
PTHH :
Pb(NO3)2 + H2S → PbS + 2HNO3
0,1 0,1 (Mol)
Fe + 2HCl → FeCl2 + H2
0,01 0,01 (Mol)
⇒ nFe = nH2 = 0,01 mol
⇒ mFe = 0,01.56 = 0,56 gam
FeS + 2HCl → FeCl2 + H2S
0,1 0,1 (Mol)
⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1.88 = 8,8 gam
=>VH2S=0,1.22,4=2,24l
%m FeS=\(\dfrac{8,8}{0,56+8,8}100\)=94,02%
=>%m Fe=5,98%
Chị lớp 12 giài bài 11 này đi: https://hoc24.vn/cau-hoi/bai-ankin-giup-mk-voi.5369779678773

`Fe + 2HCl -> FeCl_2 + H_2 ↑`
`0,2` `0,2` `(mol)`
`FeS + 2HCl -> FeCl_2 + H_2 S↑`
`0,1` `0,1` `(mol)`
`H_2 S + Pb(NO_3)_2 -> PbS↓ + 2HNO_3`
`0,1` `0,1` `(mol)`
`n_[PbS] = [ 23,9 ] / 239 = 0,1 (mol)`
`n_Y = [ 6,72 ] / [ 22,4 ] = 0,3 (mol)`
`a)` Hỗn hợp `Y` gồm khí `H_2` và `H_2 S`
`=> n_[H_2 S] = 0,1 (mol)`
`=> n_[H_2] = 0,3 - 0,1 = 0,2 (mol)`
`b)m_[hh] = 0,2 . 56 + 0,1 . 88 = 20 (g)`

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

Đáp án A
Khi cho kẽm vào dung dịch Y, sau khi phản ứng xong thì thấy khối lượng thanh kẽm tăng nên trong Y phải có ion Ag+. Do AgNO3 dư nên đặt


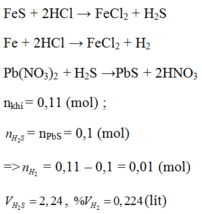
\(n_{Na_2S}=\dfrac{7,8}{78}=0,1mol\)
\(Na_2S+Pb\left(NO_3\right)_2\rightarrow2NaNO_3+PbS\downarrow\)
0,1 0,1
\(m_{PbS}=0,1\cdot\left(207+32\right)=23,9g\)
Chọn A.