
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Câu 6:
nAl=3,24/27=0,12(mol); nO2= 4,48/22,4=0,2(mol)
PTHH: 4 Al + 3 O2 -to-> 2 Al2O3
Ta có: 0,12/4 < 0,2/3
=> O2 dư, Al hết, tính theo nAl
=> nAl2O3(LT)= nAl/2= 0,12/2=0,06(mol)
nAl2O3(TT)=4,59/102=0,045(mol)
=> H= (0,045/0,06).100= 75%
Câu 7:
nMg=6/24=0,25(mol); nS= 8,8/32=0,275(mol)
PTHH: Mg + S -to-> MgS
Ta có: 0,25/1 < 0,275/1
=> Mg hết, S dư, tính theo nMg
=> nMgS(LT)=nMg= 0,25(mol)
nMgS(TT)= 10,08/56= 0,18(mol)
=>H= (0,18/0,25).100=72%


PTHH :
C + O2 \(\rightarrow\) CO2
a) Đốt cháy hoàn toàn C => C hết
mà sau PỨ chỉ thu được một chất khí duy nhất => khí đó là CO2 => O2 phải phản ứng hết.
Ta có : nC = m/M = 3/12 = 0,25(mol)
Theo PT => nC = nCO2 = 0,25(mol)
=> VO2 = 0,25 . 22,4 = 5,6(l)
b) C phản ứng hết
mà sau phản ứng thu được 2 chất khí => 2 chất khí đó gồm \(\left\{{}\begin{matrix}O_{2\left(dư\right)}\\CO_2\end{matrix}\right.\)
Mặt khác có VCO2 = n .22,4 = 0,25 . 22,4 = 5,6(l)
mà thu được hỗn hợp 2 chất khí có thể tích = nhau => VCO2 = VO2(dư) = 5,6(l)
Theo PT => nO2(PỨ) = nC = 0,25(mol)
=> VO2(PỨ) = n . 22,4 = 0,25 x 22,4 =5,6(l)
Dó đó : VO2(cần dùng) = VO2(phản ứng) + VO2(dư) = 5,6 + 5,6 =11.2(l)

Bản tường trình
|
Tên thí nghiệm |
Mục đích thí nghiệm |
Hiện tượng | Kết luận |
| Tách riêng chất từ hỗn hợp muối ăn và cát | Biết cách tách riêng chất từ hỗn hợp hai chất |
+) Muối tan trong nước, cát không tan +) Cát được tách riêng trên giấy lọc +)Khi đun, lượng nước bay hơi từ từ, ta được muối tinh khiết hơn muối ban đầu |
-Tách riêng được muối và cát. -Thu được muối tinh khiết |

Phần tự luận
Câu 3
a, * Phần tính toán :
Theo đề bài ta có
Số mol của MgSO4 có hòa tan trong 100 ml dung dịch MgSO4 0,4M là
nMgSO4= CM.V=\(\dfrac{100.0,4}{1000}=0,04mol\)
Thể tích dung dịch MgSO4 2M là
VddMgSO4=\(\dfrac{n}{CM}=\dfrac{0,04}{2}=0,02l=20ml\)
*Cách pha chế :
Đong lấy 20ml dung dịch MgSO4 2M cho vào lọ tam giác chó chia vạch và có dung tích là 200ml .Thêm từ từ nước cất vào lọ đến vạch 100ml , lắc đều ta được 100ml dung dịch MgSO4 0,4 M
b, *Cách tính toán :
Theo đề bài ta có
Khối lượng chất tan MgSO4 có trong 250g dd MgSO4 0,1% là
mMgSO4=\(\dfrac{C\%.m\text{dd}}{100\%}\)=\(\dfrac{0,1\%.250}{100\%}=0,25g\)
Khối lượng dung môi ( nước ) cần dùng để pha chế là
mdm=mdd-mct=250-0,25=249,75 g
*Cách pha chế : Cân lấy 0,25g MgSO4 cho vào cốc thủy tinh có chia vạch và có dung tích là 300 ml . Cân lấy 249,75g nước cất hoặc đong lấy 249,75 ml nước cất đổ vào cốc dùng đũa thủy tinh khuấy đều cho tan hết ta được 250g dd MgSO4 0,1%
A TRẮC NGHIỆM
1a 2d 3b 4b
5. 1-a 2-d 3-b 4-c
B TỰ LUẬN
câu 1:
HCl, Ca(OH)2,BẠC NITRAT, SẮT 3 OXIT
cÂU 2;
A)PTPỨ
Zn + 2HCl ------> ZnCl2 + H2
1 2 1 1
b)mHCl=C%*mdd/100=7.3*50/100=3.65g
nHCl=3.65/65=0.05mol
nZn=0.05*1/2=0.025 mol
mZn=0.025*65=3.25g
c)nH2=0.025MOL
VH2=0.025*22.4=0.56 lít
D)nZNCl2=0.025mol
mzncl2=0.025*136=3.4g
sai đó đug chép
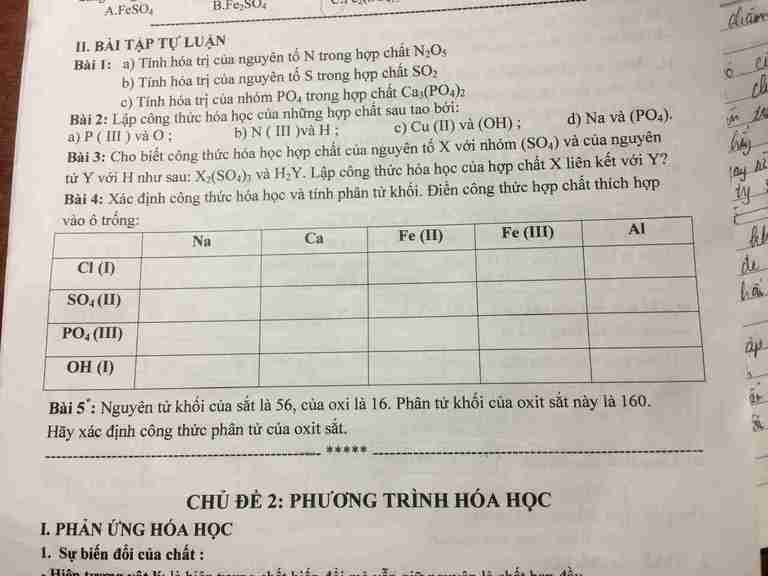






Bài 2: CTHH của câu d là Na3PO4
Bài 4:
NaCl
58,5
CaCl2
111
FeCl2
127
FeCl3
162,5
AlCl3
133,5
Na2SO4
142
CaSO4
136
FeSO4
152
Fe2(SO4)3
400
Al2(SO4)3
342
Na3PO4
164
Ca3(PO4)2
310
Fe3(PO4)2
358
FePO4
151
AlPO4
122
NaOH
40
Ca(OH)2
74
Fe(OH)2
90
Fe(OH)3
107
Al(OH)3
78