
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1 : $n_{Na} = \dfrac{m}{M} = \dfrac{2,3}{23} = 0,1(mol)$
Câu 2 : $V_{O_2} = n.22,4 = 0,05.22,4 = 1,12(lít)$
Câu 3 : $d_{SO_2/H_2} = \dfrac{64}{2} = 32 > 1$
Vậy khí $SO_2$ nặng hơn $H_2$ 32 lần

\(n_{Al}=\dfrac{3,78}{27}=0,14mol\)
\(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,14 0,25 0 0
0,14 0,21 0,07 0,21
0 0,04 0,07 0,21
a)Sau phản ứng, axit sunfuric còn dư và dư:
\(m_{H_2SO_4dư}=0,04\cdot98=3,92g\)
b)\(V_{H_2}=0,21\cdot22,4=4,704l\)
c)\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,15 0,21 0,15
\(m_{Cu}=0,15\cdot64=9,6g\)
\(n_{Al}=\dfrac{3,78}{27}=0,14\left(mol\right)\\ n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
\(pthh:2Al+6H_2SO_4->Al_2\left(SO_4\right)_3+3H_2\)
LTL : \(\dfrac{0,14}{2}>\dfrac{0,25}{6}\)
=> Al dư H2SO4 hết
theo pthh : \(n_{Al\left(p\text{ư}\right)}=\dfrac{1}{3}n_{H_2SO_4}=\dfrac{1}{12}\left(mol\right)\)
=> \(m_{Al\left(d\right)}=\left(0,14-\dfrac{1}{12}\right).27=1,53\left(g\right)\)
theo pthh : \(n_{H_2}=n_{H_2SO_4}=0,25\left(mol\right)\)
=> \(V_{H_2}=0,25.22,4=5,6\left(L\right)\)
\(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\\ pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
LTL :\(\dfrac{0,15}{1}< \dfrac{0,25}{1}\)
=> H2 dư , CuO hết
theo pthh : nCu = nCuO = 0,15 (mol)
=> \(m_{Cu}=0,15.64=9,6\left(g\right)\)

- Cốc A: \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(n_{CaCO_3}=\dfrac{25}{100}=0,25\left(mol\right)=n_{CO_2}\)
Có: m cốc A tăng = mCaCO3 - mCO2 = 25 - 0,25.44 = 14 (g) = m cốc B tăng
- Cốc B: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
GọI: nAl = x (mol) \(\Rightarrow n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}x\left(mol\right)\)
Có: m cốc B tăng = 14 (g) = 27x - 3/2x.2
⇒ x = 7/15 (mol)
\(\Rightarrow a=m_{Al}=\dfrac{7}{15}.27=12,6\left(g\right)\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\\ c.n_{HCl}=2n_{Zn}=0,4\left(mol\right)\\ \Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)

a.b.\(n_{Al}=\dfrac{m}{M}=\dfrac{3,24}{27}=0,12mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,12 0,12 0,18 ( mol )
\(V_{H_2}=n.24,79=0,18.24,79=4,4622l\)
\(m_{AlCl_3}=n.M=0,12.133,5=16,02g\)
c.\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{8}{160}=0,05mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,05 < 0,18 ( mol )
0,05 0,1 ( mol )
\(m_{Fe}=n.M=0,1.56=5,6g\)

- Trích một ít các chất làm mẫu thử, đánh số thứ tự lần lượt
- Cho các dd tác dụng với giấy quỳ tím:
+ QT chuyển đỏ: HCl
+ QT chuyển xanh: NaOH
+ QT không chuyển màu: NaCl

(a) Xét \(\dfrac{120}{250}.100=48\) => ddbh và có KCl không bị hoà tan hết
\(\left(b\right)m_{KCl\left(tan\right)}=\dfrac{250}{100}.42,6=106,5\left(g\right)\\ \rightarrow m_{KCl\left(ko.tan\right)}=120-106,5=13,5\left(g\right)\)


2d.
\(2C_xH_yO_z+\left(4x+y-z\right)O_2\underrightarrow{^{^{t^0}}}2xCO_2+yH_2O\)
3.a
CTHH có dạng : \(Ba_xO_y\)
\(\%Ba=\dfrac{137x}{153}\cdot100\%=89.5425\%\)
\(\Rightarrow x=1\)
\(M=137+16y=153\left(g\text{/}mol\right)\)
\(\Rightarrow y=1\)
CT : BaO
3b
\(\%S=\dfrac{32}{80}\cdot100\%=40\%\)
\(\%O=\dfrac{48}{80}\cdot100\%=60\%\)





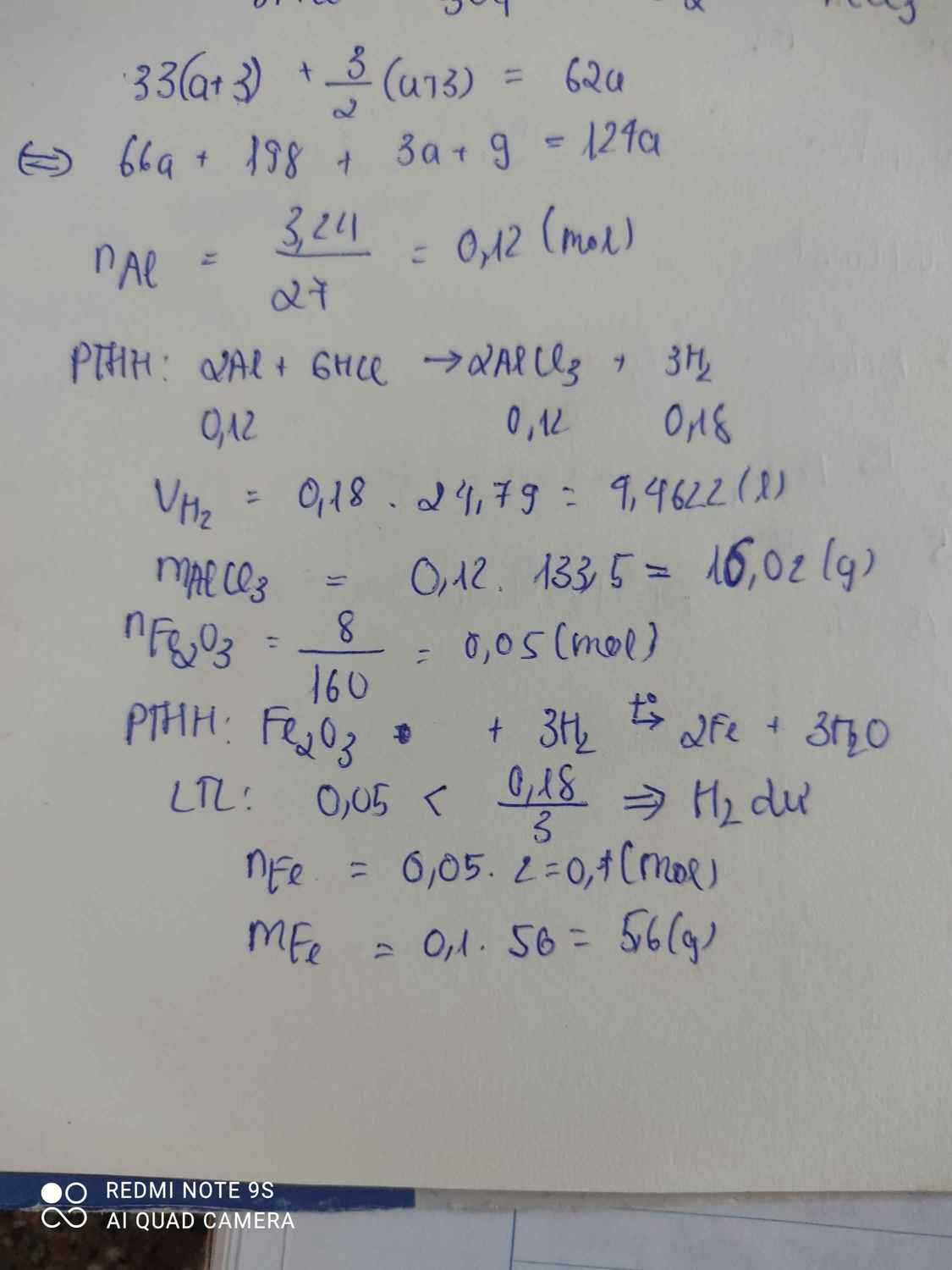
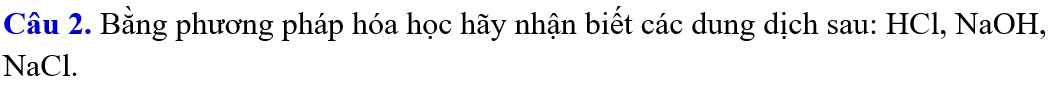



Câu 1.
a) \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\) (2)
b) \(n_{H_2}=n_{Zn}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,15.65}{21,9}.100=44,52\%\)
\(\Rightarrow\%ZnO=100-44,52=55,48\%\)
c)\(n_{HCl\left(bđ\right)}=0,8.0,5=0,4\left(mol\right)\)
\(n_{HCl\left(2\right)}=n_{HCl\left(bđ\right)}-n_{HCl\left(1\right)}=0,4-0,15.2=0,1\left(mol\right)\)
\(n_{ZnCl_2\left(1\right)}=n_{H_2}=0,15\left(mol\right)\)
\(n_{ZnCl_2\left(2\right)}=\dfrac{1}{2}n_{HCl\left(2\right)}=0,05\left(mol\right)\)
\(C_{M\left(ZnCl_2\right)}=\dfrac{0,15+0,05}{0,8}=0,25M\)
2. CuO không tan trong nước nên không tính được nồng độ dung dịch thu được em nhé!
3. \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(n_{Na}=\dfrac{6,9}{23}=0,3\left(mol\right)\)
\(n_{H_2}=\dfrac{1}{2}n_{Na}=0,15\left(mol\right)\)
\(V_{H_2}=0,15.22,4=3,36\left(mol\right)\)
b) \(C\%_{NaOH}=\dfrac{0,3.40}{6,9+120-0,15.2}.100=9,48\%\)