Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Trong phản ứng hóa học có sự tham gia của chất khí, áp xuất sẽ ảnh hưởng đến tốc độ phản ứng
=> Yếu tố áp suất ảnh hưởng đến tốc độ phản ứng (1)
- Khi tăng áp suất, tốc độ phản ứng tăng

a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2
b)
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3)
=> v2 tăng 3 lần so với v1
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2
=> v3 tăng 9 lần so với v1
- Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2
=> v4 tăng 27 lần so với v1

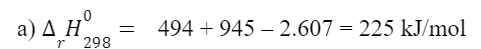
b) Trong N2, liên kết giữa 2 nguyên tử là liên kết ba – một loại liên kết bển, cần 1 năng lượng rất lớn để phá vỡ liên kết đó.
=> N2 khá trơ về mặt hóa học và chỉ phản ứng với oxy khi có nhiệt đô cao hoặc có tia lửa điện

a) Biểu thức tốc độ tức thời của phản ứng là:
v1 = k.CCl2.CH2
b) Gọi CCl2 là nồng độ ban đầu của Cl, CH2 là nồng độ đầu của H2
=> v2 = k. CCl2.CH2 :2
=> 2v2 = v1
=> Tốc độ phản ứng giảm 1 nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2

Để tăng tốc độ phản ứng có thể sử dụng một số cách như:
- Tăng nhiệt độ.
- Hoặc tăng nồng độ của các chất tham gia phản ứng.
- Hoặc có thể sử dụng những chất xúc tác, ví dụ như Bạch Kim ( Platinum: Pt).


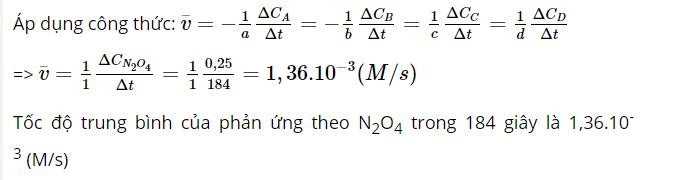
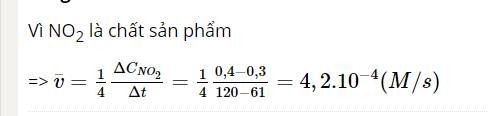
Từ phương trình hóa học nhận thấy: hệ số cân bằng của NO là 2, hệ số cân bằng của N2 là 1
=> Trong cùng thời gian, nồng độ tiêu hao của NO nhanh gấp 2 lần nồng độ tạo thành của N2