
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


gọi KL là A có hoá trị là x
--> CTHH của oxit là: A2Ox
--> VddHCl = 300ml = 0,3l --> nHCL= 0,3.1= 0,3 mol
PT: A2Ox +2x HCl----->2 AClx +x H2O
8/(2A+16x)--0,3
ta có pt toán: 16x/(2A+16x) = 0,3
=> 3A = 56x
biện luận kết quả ta đc
nếu x=I => A= 56/3 loại
nếu x=II => A= 112/3 loại
nếu x=III=> A= 56 chọn
vậy KL A là Fe(sắt) có hoá trị III => CTHH của oxit: Fe2O3
cảm ơn bạn nhưng mình không hiểu ở chỗ kê gam lên cái phương trình á bạn

Bài 2:
Giả sử KL cần tìm là A.
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
___0,3________________0,3 (mol)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: A là Magie (Mg).
Bài 3:
Giả sử: KL cần tìm là A.
Ta có: \(m_{HCl}=100.21,9\%=21,9\left(g\right)\Rightarrow n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
___0,3____0,6 (mol)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: A là Magie (Mg).
Bạn tham khảo nhé!

Bài 11:
a, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(A+H_2SO_4\rightarrow ASO_4+H_2\)
___0,2________________0,2 (mol)
\(\Rightarrow M_A=\dfrac{4,8}{0,2}=24\left(g/mol\right)\)
Vậy: A là Mg.
b, Theo PT: \(n_{H_2SO_4}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{0,2}{0,5}=0,4\left(l\right)\)
c, Theo PT: \(n_{MgSO_4}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{MgSO_4}}=\dfrac{0,2}{0,4}=0,5M\)
Bạn tham khảo nhé!
Bài 9:
Giả sử KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
____0,3___0,6 (mol)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: A là Magie (Mg)
Bạn tham khảo nhé!


PTHH: \(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
Ta có: \(n_{H_2}=\dfrac{10,752}{22,4}=0,48\left(mol\right)\) \(\Rightarrow n_{Fe_xO_y}=\dfrac{0,48}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{27,84}{\dfrac{0,48}{y}}=58y\)
Ta thấy \(\left\{{}\begin{matrix}x=3\\y=4\end{matrix}\right.\) thì thỏa mãn đề bài
Vậy oxit sắt cần tìm là Fe3O4

Ta có \(\dfrac{e+p}{25}=\dfrac{n}{27}=\dfrac{e+p+n}{25+27}=\dfrac{106}{52}=\dfrac{53}{26}\)
\(\Rightarrow n\approx54\left(hat\right)\)
\(\Rightarrow e+p=52\left(hat\right)\Rightarrow e=p=26\left(hat\right)\)
M: Sắt(Fe)
NTK= 56(g/mol)

Bài 4 : Nguyên tử
Bài tập 2:
a) Nguyên tử tạo thành từ ba loại hạt nhỏ hơn nữa, đó là những hạt nào?
b) Hãy nói tên, kí hiệu và điện tích những loại hạt mang điện?
c) Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân?
Lời giải:
a) Nguyên tử tạo thành từ ba loại nhỏ hơn nữa là: proton, electron và nơtron.
b) Tên, kí hiệu, điện tích những loại hạt mang điện
| Tên | Proton | Electron |
| Kí hiệu | p | e |
| Điện tích | +1 | -1 |
c) Những nguyên tử cùng loại có cùng số hạt proton trong hạt nhân.
Bài tập 3:
Vì sao nói khối lượng của hạt nhân được coi là khối lượng của nguyên tử?
Lời giải:
Khối lượng nguyên tử gồm khối lượng hạt nhân và khối lượng các electron, nhưng khối lượng electron quá nhỏ so với khối lượng hạt nhân, nên có thể bỏ qua. Do đó có thể coi khối lượng hạt nhân là khối lượng nguyên tử.
Bài tập 4:
Trong nguyên tử, electron chuyển động và sắp xếp như thế nào? Lấy vị dụ minh họa với nguyên tử oxi.
Lời giải:
Electron luôn chuyển động nhanh quanh hạt nhân và sắp xếp thành từng lớp.
Ví dụ: Nguyên tử oxi có 8 electron chia hai lớp, lớp trong có 2 và lớp ngoài có 6 electron.
Bài 5:
Cho biết sơ đồ một số nguyên tử sau:
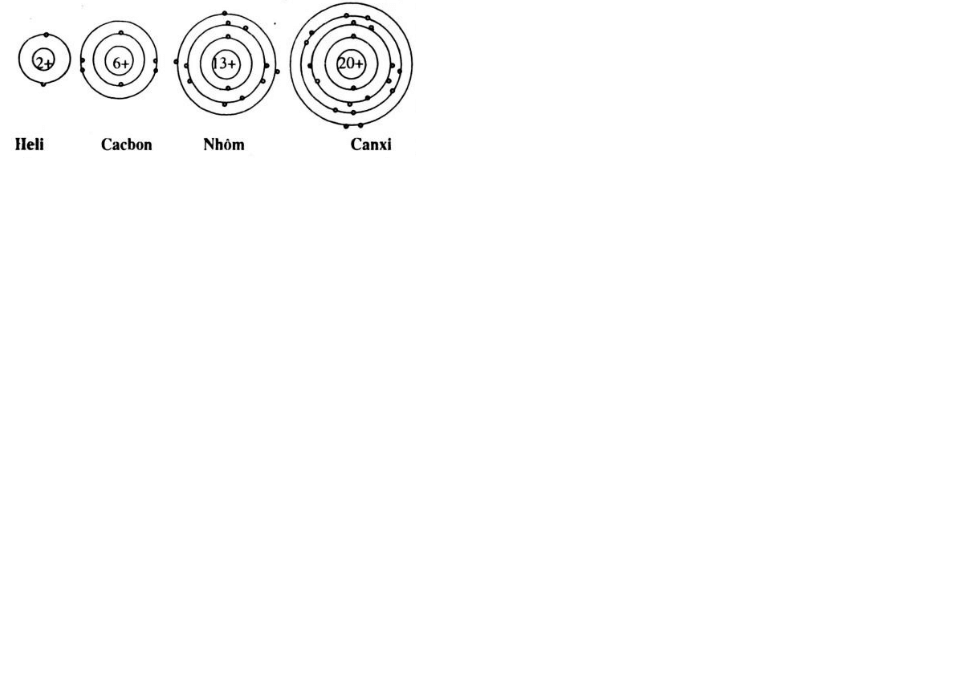
Hãy chỉ ra: Số p trong hạt nhân, số e trong nguyên tử, số lớp electron và số e lớp ngoài cùng của mỗi nguyên tử.
Lời giải:
| Nguyên tử | Số p trong hạt nhân | Số e trong nguyên tử | Số e lớp ngoài cùng | Số lớp electron |
| He | 2 | 2 | 2 | 1 |
| C | 6 | 6 | 4 | 2 |
| Al | 13 | 13 | 3 | 3 |
| Ca | 20 | 20 | 2 | 4 |
Còn bài tập 1 thì mình giải ở trên rồi nha

vì nguyên tử M có số notron nhiều hơn số proton là 1
=> n= p+1 (1)
vì số hạt mang điện nhiều hơn số hạt không mang điện là 10
=> p+e=n+10
=> 2p = n+10 (vì số p = số e) (2)
thay (1) vào (2) ta được : 2p = p +1+10
=> 2p-p =11
=> p=11
mà p =e => e=11
lại có n=p+1=> n =11+1=12
Vậy nguyên tử M có 11 hạt proton ,11 hạt electron và 12 hạt notron

Bài 5 :
Độ tan của dd KNO3 bão hòa là :
\(S=\dfrac{m_{ct}}{m_{dm}}.100\%=\dfrac{60}{190}.100\approx31,58\)
Bài 6 :
\(C\%_{NaCl}=\dfrac{5}{125}.100\%=4\%\)



 Giải hộ mình nhé.. mình cần rất gấp...
Giải hộ mình nhé.. mình cần rất gấp...
Bài 4 :
\(n_{HCl}=0.1\cdot6=0.6\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
\(0.3..........0.6\)
\(M_M=\dfrac{7.2}{0.3}=24\left(\dfrac{g}{mol}\right)\)
\(M:Mg\)
Bài 4:
Giả sử KL cần tìm là A.
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
___0,3___0,6 (mol)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: A là Magie (Mg).
Bài 5:
Giả sử KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
___0,3_____0,6 (mol)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: A là Magie (Mg).
Bạn tham khảo nhé!