Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Công thức oxit là CuO
b) V CO banđầu= 1,792 (l)
Giải thích các bước giải:
Gọi công thức của oxit kim loại A là A2On
nCO+A2Onto→nCO2+2AnCO+A2On→tonCO2+2A
Ta có: nCa(OH)2=0,0625 (mol); nCaCO3=0,05 (mol)nCa(OH)2=0,0625 (mol); nCaCO3=0,05 (mol)
-) Xét TH Ca(OH)2 dư:
Chỉ tạo một muối CaCO3 ⇒ Số mol CO2 tính theo số mol CaCO3
PTHH: CO2+Ca(OH)2→CaCO3+H2OCO2+Ca(OH)2→CaCO3+H2O
Theo PTHH: nCO2=nCaCO3=0,05 molnCO2=nCaCO3=0,05 mol
Ta có: mCO2=2,2 (g); mCO=1,4 (g)mCO2=2,2 (g); mCO=1,4 (g)
BTKL: ⇒mA=4+1,4−2,2=3,2 (g)⇒mA=4+1,4−2,2=3,2 (g)
⇒MA=mn=3,20,1n=32n⇒MA=mn=3,20,1n=32n
Vì A là kim loại nên sẽ có hóa trị nằm từ 1 đến 3
Chỉ có cặp nghiệm duy nhất thỏa mãn: {n=2M=64{n=2M=64
Vậy A là Cu ⇒ Công thức oxit là CuO
Hỗn hợp khí X sau phản ứng gồm CO2 và CO dư
MX=19.2=38 (g/mol)MX=19.2=38 (g/mol)
Gọi a là số mol của CO dư
Ta có: MX=mn=mCO dư+mCO2nCO dư+nCO2MX=mn=mCO dư+mCO2nCO dư+nCO2
MX=a.28+0,05.44a+0,05=38MX=a.28+0,05.44a+0,05=38
⇒a=0,03 (mol)⇒a=0,03 (mol)
⇒nCO ban đầu=nCO pư+nCO dư=0,05+0,03=0,08 (mol)⇒nCO ban đầu=nCO pư+nCO dư=0,05+0,03=0,08 (mol)
VCO ban đầu=0,08.22,4=1,792 (l)VCO ban đầu=0,08.22,4=1,792 (l)
-) Xét TH Ca(OH)2 đủ: Tương tự với TH trên

1/Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

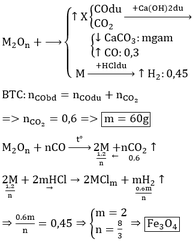
Gọi oxit kim loại là R2On Kim loại này phải có số oxh thay đổi
nCO=1,792/22,4=0,08 mol
R2On + nCO =>2 R + nCO2
0,08/n mol<=0,08 mol=>0,16/n mol
nH2=1,344/22,4=0,06 mol
2R +2mHCl =>2RClm +m H2
0,12/m mol<= 0,06 mol
=>m/n=4/3
Có 0,08/n(2R+16n)=4,64=>R=21n chọn n=8/3=>R=56 Fe
Oxit kim loại là Fe3O4
Gọi công thức oxit kim loại là :MxOy
_Tác dụng với CO:
nCO=1.792/22.4=0.08(mol)
MxOy+yCO=>xM+yCO2
0.08/y->0.08(mol)
=>nMxOy=0.08/y(1)
=>nO=0.08mol
=>mO=0.08*16=1.28(g)
=>mM=4.64-1.28=3.36(g)
nH2=1.344/22.4=0.06(mol)
2M+2nHCl=>2MCln+nH2
0.12/n----------------->0.06(mol)
=>M=3.36/0.12/n=28n
_Xét hóa trị của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
=>M là sắt (Fe)
=>nFe=0.12/2=0.06(mol)
=>nFexOy=0.06/x (2)
Từ(1)(2)=>
0.08/y=0.06/x
<=>0.08x=0.06y
<=>x/y=3/4
Vậy công thức oxit đầy đủ là Fe3O4

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.
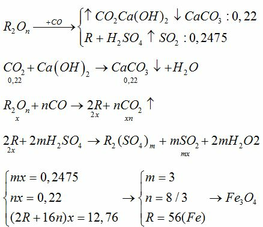
Đặt CT oxit kim loại là \(R_2O_n\)
\(R_2O_n+nCO\rightarrow\left(t^o\right)2R+nCO_2\) (1)
\(\overline{M_X}=19.2=38\) \((g/mol)\)
\(\Leftrightarrow\dfrac{28n_{CO\left(dư\right)}+44n_{CO_2}}{n_{CO\left(dư\right)}+n_{CO_2}}=38\)
\(\Leftrightarrow10n_{CO\left(dư\right)}-6n_{CO_2}=0\) (1)
\(n_{Ca\left(OH\right)_2}=2,5.0,025=0,0625\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\)
`@` TH1: chỉ tạo ra kết tủa
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,05 0,05 0,05 ( mol )
\(n_{CO_2}=0,05\) theo ptr (1)\(\Rightarrow n_{R_2O_n}=\dfrac{0,05}{n}\left(mol\right)\)
\(M_{R_2O_n}=\dfrac{4}{\dfrac{0,05}{n}}=80n\) \((g/mol)\)
\(\Leftrightarrow2R+16n=80n\)
\(\Leftrightarrow R=32n\)
`n=2->R` là Cu `->` CT oxit: \(CuO\)
`@`TH2: Ca(OH)2 hết
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,0625 ( mol )
0,05 0,05 0,05 ( mol )
\(Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
0,0125 0,025 ( mol )
\(n_{CO_2}=0,05+0,025=0,075\left(mol\right)\)
Theo ptr (1) \(n_{R_2O_n}=\dfrac{0,075}{n}\left(mol\right)\)
\(M_{R_2O_n}=\dfrac{4}{\dfrac{0,075}{n}}=\dfrac{160}{3}n\)
\(\Leftrightarrow2R+16n=\dfrac{160}{3}n\)
\(\Leftrightarrow R=\dfrac{56}{3}n\)
`n=3->R` Fe `->` CT oxit: \(Fe_2O_3\)