Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Y + HCl tạo 0,035 mol H2
![]() nFe dư = 0,035
nFe dư = 0,035
![]() nFe phản ứng với muối = 0,05 – 0,035 = 0,015
nFe phản ứng với muối = 0,05 – 0,035 = 0,015
Bảo toàn ne
![]() nAg+ + 2nCu2+ = 3nAl + 2nFe = 0,12
nAg+ + 2nCu2+ = 3nAl + 2nFe = 0,12
Do Ag+ và Cu2+ cùng nồng độ
![]() nAg+ = nCu2+ = 0,04
nAg+ = nCu2+ = 0,04
![]() [Ag+] = [Cu2+] = 0,04/0,1 = 0,4M
[Ag+] = [Cu2+] = 0,04/0,1 = 0,4M
![]() Chọn B.
Chọn B.

Đáp án A
Gọi x = nN2, y = nNO2
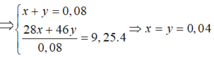
Bảo toàn nguyên tố N => nHNO3 = nNO3- tạo muối + 2nN2 + nNO2
nHNO3 = (10nN2 + nNO2) + 2nN2 + nNO2 = 0,56=> CM của HNO3 = 0,56/2 = 0,28M

Fedư => AgNO3,Cu(NO3)2 và Al phản ứng hết, phản ứng
Bảo toàn electron ta có: ne cho= nenhận
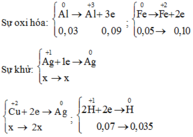
Bảo toàn electron ta có: ne cho= nenhận
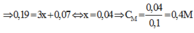

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến
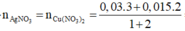
 với các chất sau:
với các chất sau:
Cho Y chứa 3 kim loại, tác dụng với dung dịch HCl dư thu được 0,035 mol khí H2 → Y chứa Fe dư
Vậy Y chứa Cu : x mol , Ag: x mol và Fe dư : 0,035 mol
⇒ Fe pư : 0,05 - 0,035 = 0,015 mol
Bảo toàn electron → 2nCu(NO3)2 + nAgNO3 = 2nFe + 3nAl
⇒ 2x + x = 2. 0,015 + 0,03. 3 → x = 0,04 mol
⇒ CMCu(NO3)2 = CMAgNO3 = 0,04 : 0,1 = 0,4M
Đáp án B