Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có 0,1 mol chất béo \(\Rightarrow\) tạo ra 0,1 mol glixerol.
\(\Rightarrow\) m = 0,1 x 92 = 9,2 gam.

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất

Coi như cho cả X và H2SO4 cùng lúc vào dd kiềm (vừa đủ) thì kết quả sinh ra vẫn là muối và nước. Dung dịch sau cùng chưa các ion: \(H_2N-C_xH_y-\left(COO\right)^{2-};K^+;Na^+;SO_4^{2-}.\)
Có ngay: \(n_{H^+}=n_{OH^-}=2n_X+2n_{H_2SO_4}=0,4\left(mol\right)\)
Mà \(n_{K+}=3n_{Na+}\Rightarrow n_{K+}=0,3\left(mol\right);n_{Na+}=0,1\left(mol\right)\)
\(m_{H_2N-C_xH_y-\left(COO\right)^{2-}}=m_{muối}-m_{K+}-m_{Na+}-m_{SO_4^{2-}} \\ =36,7-0,3\cdot39-0,1\cdot23-0,1\cdot96=13,1\left(gam\right)\)
\(M_{H_2N-C_xH_y-\left(COO\right)^{2-}}=\frac{13,1}{0,1}=131\\ \Rightarrow M_X=131+2=133\\ \Rightarrow\%N=\frac{14}{133}\cdot100\%\approx10,526\%\)
cho m gam axit glutamicvaof dung dịch NAOH thu được dd X chứa 23,1 gam chất tan . để tác dụng vừa đủ với chất tantrong X cần dùng 200ml dung dịch HCL 1M và H2S4O 0,5M thu được dung dịch chứa 38,4 gam hỗn hợp muối .m=?

C4H7OH(COOH)2 + 2NaOH---> C4H7OH(COONa)2 + 2H2O)
C4H7OH(COONa)2+ 2HCl ----> C4H7OH(COOH)2+ 2NaCl
C4H7OH(COOH)2 + 3Na----> C4H7ONa(COONa)2+ 3/2 H2
0,1 0,15 mol
=> nH2= 0,15 mol
Từ các phản ứng trên ta suy ra X là anhiđrit có công thức là (HO − CH2 − CH2−CO)2O
Từ đó suy ra Z là acid có công thức : HOCH2CH2COOH
Khi lấy 0,1 mol Z tác dụng với NaOH thì ta thu được 0,1 mol H2.
Chọn B

Số mol H2 = 0,2 mol . số mol Cl2 = 0,175 mol
Đặt số mol Zn,Fe,Cu trong 18,5 g hỗn hợp lần lượt là a,b,c
Ta có phương trình : 65a + 56b + 64c =18,5 (1)
Số mol Zn,Fe,Cu trong 0,15mol hốn hợp lần lượt sẽ là at, bt, ct
Cho hỗn hợp tác dụng với axit HCl ta có phản ứng :
Zn + 2HCl ZnCl2 + H2
a a
Fe + 2HCl FeCl2 + H2
b b
ta có a+b = 0,2 (2)
cho 0,15 mol hốn hợp tác dụng với Cl2 ta cs phương trình phản ứng :
Zn + Cl2 ZnCl2
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
Như vậy ta có phương trình : at + bt + ct = 0,175
Với at + bt + ct =0,15
Chia lần lượt 2 vế của 2 phương trình cho nhau ta được
= a -2b + c =0 (3)
Giải hệ phương trình (1),(2),(3) ta thu được a=0,1 . b= 0,1 c= 0,1
tôi ko hiểu chỗ "Số mol Zn,Fe,Cu trong 0,15 mol hỗn hợp lần lượt là at,bt ,ct" giải thích giùm mk đi

Căn cứ vào các tính chất của các halogen ta thấy chỉ có C3H7Cl phản ứng được với dung dịch NaOH đun nóng. Đặt công thức của Y là RCl, phương trình phản ứng :
C3H7Cl + NaOH = C3H7OH + NaCl (1)
mol: x x
AgNO3 + NaCl = AgCl + NaNO3 (2)
mol: x x
Theo (1), (2) và giả thiết ta có :
nC3H7Cl = nNaCl = nAgCl = 1,435/143,5 = 0.01 mol;
mC6H5Cl = 1,91 - 0,01.78,5 = 1,125 gam.

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

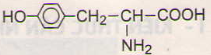 với các chất sau:
với các chất sau:
Đáp án :C