Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

(1) \(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
(2) \(2SO_2+O_2\xrightarrow[_{V_2O_5}]{^{t^o}}2SO_3\)
(3) \(nSO_3+H_2SO_4\rightarrow H_2SO_4.nSO_3\)
(4) \(H_2SO_4.nSO_3+nH_2O\rightarrow\left(n+1\right)H_2SO_4\)
a) 4FeS2 + 11O2 → 2Fe2O3 +8SO2 (1)
Phản ứng (1) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: FeS2
2SO2 + O2 →𝑡𝑜,𝑉2𝑂5 2SO3 (2)
Phản ứng (2) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: SO2
SO3 + H2O → H2SO4 (3)
Phản ứng (3) không là phản ứng oxi hoá - khử
b) 1 tấn quặng chứa 60% FeS2 (M = 120 g/𝑚𝑜𝑙−1)
Số mol FeS2 trong 1 tấn quặng trên là: 106120.60100= 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: 0,9898.100=1tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
1.80100=0,8 tấn.
c) Trong FeS2 nguyên tố S có số oxi hóa -1, đề xuất công thức cấu tạo là:

Có thể tính như sau: Trong 310 gam Ca3(PO4)2(3CaO.P2O5) có chứa x gam P2O5.
Từ đó ta tính được khối lượng P2O5: x = 142 x (35 : 310) = 16 (g)
Hàm lượng P2O5 là 6%.

Dung dịch sulfuric acid đặc được dùng làm khô khí H2, CO2, SO2, O2
Vì: Do sulfuric acid đặc có tính oxi hoá mạnh nên sẽ tác dụng được với những chất có tính khử mạnh như: NH3, CO

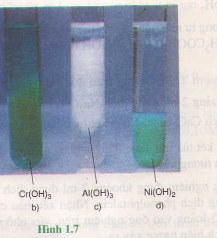
Cr(NO3)3 + 3NaOH(vừa đủ) → Cr(OH)3↓ + 3NaNO3 ;
AlCl3 + 3KOH (vừa đủ) → Al(OH)3↓ + 3KC1 ;
Ni(NO3)2 + 2NaOH → Ni(OH)2↓+ 2NaNO3.
nhìn cái ảnh này là thể hiện tự đăng rồi. Bữa trước môn sinh cũng thế chứ đâu
Phương trình hóa học:
\(Ca_3\left(PO_4\right)_2+2H_2SO_{4\left(đặc\right)}\rightarrow Ca\left(H_2PO_4\right)_2+2CaSO_4.\)
\(Ca_3\left(PO_4\right)_2+3H_2SO_{4\left(đặc\right)}\rightarrow2H_3PO_4+3CaSO_4.\)
\(Ca_3\left(PO_4\right)_2+2H_2SO_4\left(đ\right)\rightarrow Ca\left(H_2PO_4\right)_2+2CaSO_4\)
\(Ca_3\left(PO_4\right)_2+3H_2SO_4\left(đ\right)\rightarrow2H_3PO_4+3CaSO_4\)