Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
nH2S = nMgS = nS = 0,15 mol;
nH2= nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
=> MY = (0,15.34+0,05.2)/(0,15+0,05)=26

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
FeS + 2HCl \(\rightarrow\) FeCl2 + H2S
H2S + Pb(NO3)2 \(\rightarrow\) PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.

Em có thể tham khảo cách giải sau:
Ta có: mO2 = (15,8 + 24,5)-36,3 = 4 gam. => nO2 = 0,125 mol.
nKMnO4 = 0,1 mol, nKClO3 = 0,2 mol.
Mn7+ + 5e -> Mn2+
Cl5+ + 6e -> Cl-1
2O2- -> O2 + 4e
2Cl-1 -> Cl2 + 2e
Bảo toàn electron, ta có: 0,1*5 + 0,2*6 = 0,125*4 + 2*nCl2
=> nCl2 =0,6 mol.
3Cl2 + 6NaOH -> 5NaCl + NaClO3 + 3H2O (vì đun nóng).
Bđ 0,6 1,5
P/ư 0,6 1,2 1,0 0,2
Sau p/ư 0 0,3 1,0 0,2.
=> m Rắn =0,3*40 + 1,0*58,5 + 0,2*106,5 = 91,8 gam.

Câu 1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x________x__(mol)
\(Al+2HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
y_____2y______y______3/2y__(mol)
\(n_{khí}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}24x+27y=10,2\\x+\frac{3}{2}y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\%m_{Mg}=\frac{10,2-\left(24.0,2\right)}{0,2}.100\%=52,94\%\)
\(\%m_{Al}=100\%-52,94\%=47,06\%\)
\(m_{muoi}=95.0,2+133,5.0,2=28,6\left(g\right)\)
\(V_{HCl}=1,6\left(l\right)\)
Dùng 7,5% \(\Rightarrow V=1,6-1,6.7,5\%=1,48\left(l\right)\)
Câu 2:
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(n_{FeCl2}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow n_{AgCl}=2n_{FeCl2}=2.0,2=0,4\left(mol\right)\)
\(m_{AgCl}=0,4.143,5=57,4\left(g\right)\)
\(n_{Fe\left(NO3\right)2}=n_{FeCl2}=0,2\left(mol\right)\)
V dd sau phản ứng= VFeCl2 + VAgNO3 = 0,2+0,3= 0,5 (l)
\(\Rightarrow CM_{FeCl2}=\frac{0,2}{0,5}=0,4M\)

nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

1.
a)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , HNO3 (nhóm 1 )
Quỳ tím chuyển thành màu xanh : KOH , Ba(OH)2 ( nhóm 2 )
Quỳ tím không xảy ra hiện tượng : NaCl và NaNO3 (nhóm 3 )
*Cho AgNO3 vào ( nhóm 1 ) ta được :
Kết tủa trắng : HCl
\(AgNO3+HCl\rightarrow AgCl\downarrow+HNO3\)
Không xảy ra hiện tượng : HNO3
*Cho AgNO3 vào (nhóm 3) ta được :
Kết tủa trắng : NaCl
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
Không xảy ra hiện tượng :NaNO3
*Cho H2SO4 vào ( nhóm 2) ta được :
Kết tủa trắng : Ba(OH)2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
Không xảy ra hiện tượng : KOH
b)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , H2SO4 (nhóm 1)
Quỳ tìm chuyển thành màu xanh : NaOH
Không xảy ra hiện tượng :NaCl , NaBr ; NaI (nhóm 2)
*Cho AgNO3 vào (nhóm 1) ta được
Kết tủa trắng HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Không xảy ra hiện tượng H2SO4
Cho AgNO3 vào (nhóm 3) ta được
Kết tủa trắng là : NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Chuyển thành màu vàng nhạt là :NaBr
\(AgNO3+NaBr\rightarrow AgBr\downarrow+NaNO_3\)
Chuyển thành màu vàng : NaI
\(AgNO_3+NaI\rightarrow AgI\downarrow+NaNO_3\)
2.
Cho hỗn hợp X vào HCl chỉ có Fe phản ứng:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)=n_{Fe}\)
Cho X tác dụng với Cl2
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(\rightarrow n_{FeCl3}=n_{Fe}=0,02\left(mol\right)\)
\(\rightarrow m_{FeCl3}=0,02.\left(56+35,5.3\right)=3,25\left(g\right)\)
\(m_{CuCl2}=7,3-3,25=4,05\left(g\right)\)
\(\rightarrow n_{CuCl2}=\frac{4,05}{64+35,5.2}=0,03\left(mol\right)=n_{Cu}\)
\(\rightarrow m=m_{Fe}+m_{Cu}=0,02.56+0,03.64=3,04\left(g\right)\)
3.
Gọi số mol Al là x; Fe là y
\(\rightarrow27x+56y=8,3\left(g\right)\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\rightarrow n_{H2}=1,5n_{Al}+n_{Fe}=1,5x+y=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Giải được \(x=y=0,1\)
\(\rightarrow m_{Al}=0,1.27=2,7\left(g\right)\)
\(\rightarrow\%m_{Al}=\frac{2,7}{8,3}=32,5\%\rightarrow\%m_{Fe}=100\%-32,5\%=67,5\%\)
Ta có muôí gồm AlCl3 và FeCl2
\(\rightarrow m_{muoi}=0,1.\left(27+35,5.3\right)+0,1.\left(56+35,5.2\right)=20,05\left(g\right)\)
b) Ta có: nHCl phản ứng=2nH2=0,5 mol
\(n_{HCl_{tham.gia}}=0,5.120\%=0,6\left(mol\right)\)
\(\rightarrow V_{HCl}=\frac{0,6}{1}=0,6\left(l\right)\)
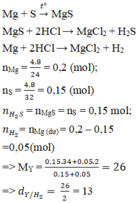
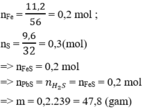
Đáp án B
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol), nS = 0,15 9mol)
nH2S = nMgS = nS = 0,15 mol;
nH2 = nMg (dư) = 0,2 – 0,15 =0,05 (mol)