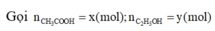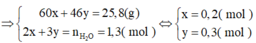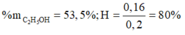Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phần trăm khối lượng của axit đã tham gia phản ứng : 70,0%
CH3COOH + C2H5OH <=> CH3COOC2H5 + H2O
neste = naxit phản ứng = 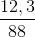 = 0,14o mol;
= 0,14o mol;
nCH3COOH = 0,200 mol
Phần trăm khối lượng của axit đã tham gia phản ứng: 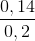 . 100% = 70%
. 100% = 70%
Xem thêm tại: http://loigiaihay.com/bai-7-trang-210-sgk-hoa-hoc-11-c54a8805.html#ixzz4fAp9Rw8m

Phương trình hóa học:
CH3COOH + C2H5OH ---H2SO4→ CH3COOC2H5 + H2O

Lời giải
Xét thí nghiệm 1 ta có: n C H 3 C O O H = 0 , 2 ( m o l ) ; n C 2 H 5 O H = 1 , 05 ( m o l )
Ta có kết tủa là BaSO4 n B a S O 4 = 0 , 02 ( m o l ) ; n H 2 S O 4 = 0 , 02 ( m o l )
Có n C O 2 = 0 , 09 ( m o l ) trong X có CH3COOH dư;
n C H 3 C O O H d ư = n C O 2 - 2 n H 2 S O 4 = 0 , 05 ( m o l ) ⇒ n e s t e = n H 2 O = 0 , 2 - 0 , 05 = 0 , 15 ( m o l ) ⇒ m e s t e = 13 , 2 ( g ) ; n C 2 H 5 O H = 1 , 05 - 0 , 15 = 0 , 9 ( m o l )
=> Khi ở trạng thái cân bằng ta có K C = 0 , 15 . 0 , 15 0 , 9 . 0 , 05 = 0 , 5
Ở thí nghiệm 2 ta có:
n C H 3 C O O H = 0 , 16 ( m o l ) ; n C 2 H 5 O H = 0 , 32 ( m o l ) ; n H 2 O t r o n g d d a x i t 19 30 ( m o l )
Ở trạng thái cân bằng, gọi n e s t e = x ( m o l )
⇒ n C H 3 C O O H = 0 , 16 - x ( m o l ) ; n C 2 H 5 O H = 0 , 32 - x ( m o l ) n H 2 O = 19 30 + x ( m o l )
. Vì KC không đổi
⇒ x 19 30 + x ( 0 , 16 - x ) ( 0 , 32 - x ) = 0 , 5 ⇒ x = 0 , 29
Vậy meste = 2,552(g)
Đáp án C.

Đáp án A
Hướng dẫn CH3COOH + C2H5OH ⇄ H 2 S O 4 đ , t o CH3COOC2H5 + H2O
nCH3COOC2H5 theo pt = nCH3COOH = 0,4 mol
Mà nCH3COOC2H5 thực tế thu được = 0,3 mol
=> H = nCH3COOC2H5 thực tế thu được / nCH3COOC2H5 theo pt = 0,3 / 0,4 = 75%

Chọn đáp án D
Cứ 1 phân tử CH3COOH → 1 phân tử CH3COOC2H5.
+ Nhận thấy nCH3COOH = 0,2 mol và nCH3COOC2H5 = 0,125 mol
⇒ H = 0 , 125 0 , 2 × 100 = 62,5% ⇒ Chọn D

Đáp án D
Hỗn hợp gồm CH3COOH và C2H5OH
=>este là CH3COOC2H5 =>neste = 0,16(mol)
Khi đốt cháy hỗn hợp ta có:
![]()
![]()