Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 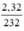 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.

a) Phương trình hóa học của phản ứng:
3Fe + 2O\(_2\) → Fe\(_3\)O\(_4\).
nFe3O4 = \(\dfrac{2,32}{232}\) = 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
a.
\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,03 0,02 0,01 ( mol )
\(m_{Fe}=0,03.56=1,68g\)
\(m_{O_2}=0,02.32=0,64g\)
b.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,04 0,02 ( mol )
\(m_{KMnO_4}=0,04.158=6,32g\)

\(n_{Fe_3O_4}=\dfrac{2.32}{232}=0.01\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{t^0}}Fe_3O_4\)
\(0.03......0.02.........0.01\)
\(m_{Fe}=0.03\cdot56=1.68\left(g\right)\)
\(m_{O_2}=0.02\cdot32=0.64\left(g\right)\)
\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(0.04............................................0.02\)
\(m_{KMnO_4}=0.04\cdot158=6.32\left(g\right)\)
a)
n Fe3O4 = 2,32/232 = 0,01(mol)
3Fe + 2O2 \(\xrightarrow{t^o}\) Fe3O4
0,03....0,02.......0,01...........(mol)
m Fe = 0,03.56 = 1,68(gam)
m O2 = 0,02.32= 0,64(gam)
c)
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
n KMnO4 = 2n O2 = 0,04(mol)
m KMnO4 = 0,04.158 = 6,32 gam

Bài 5:
a,\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,03 0,02 0,01
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03.56=1,68\left(g\right)\\m_{O_2}=0,02.32=0,64\left(g\right)\end{matrix}\right.\)
b, \(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,04 0,02
\(\rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)
Bài 6:
a, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\)
LTL: \(\dfrac{0,2}{4}< \dfrac{0,3}{5}\) => O2 dư
\(\rightarrow\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\n_{P_2O_5}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}V_{O_2\left(dư\right)}=\left(0,3-0,25\right).22,4=1,12\left(l\right)\\m_{P_2O_5}=0,1.142=14,2\left(g\right)\end{matrix}\right.\)

Sửa đề: 4,46 (g) → 4,64 (g)
a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
\(n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\Rightarrow m_{O_2}=0,04.32=1,28\left(g\right)\)
b, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2n_{O_2}=0,08\left(mol\right)\Rightarrow m_{KMnO_4}=0,08.158=12,64\left(g\right)\)

a, PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
b, Ta có: \(n_{Cu}=\dfrac{16,8}{64}=0,2625\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{O_2}=\dfrac{1}{2}n_{Cu}=0,13125\left(mol\right)\\n_{CuO}=n_{Cu}=0,2625\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{O_2}=0,13125.32=4,2\left(g\right)\)
\(m_{CuO}=0,2625.80=21\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,2625\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2625.158=41,475\left(g\right)\)
Bạn tham khảo nhé!

a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\\n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
\(m_{O_2}=0,04.32=1,28\left(g\right)\)
b, Phần này đề bài cho là KMnO4 hay KClO3 vậy bạn?

a,\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,03<--0,02<-------0,01
\(\left\{{}\begin{matrix}m_{Fe}=0,03.56=1,68\left(g\right)\\m_{O_2}=0,02.32=0,64\left(g\right)\end{matrix}\right.\)
b, PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,04<-----------------------------------0,02
\(m_{KMnO_4}=\dfrac{0,04.158}{85\%}=7,435\left(g\right)\)

a. \(n_{Fe_3O_4}=\dfrac{2.32}{232}=0,01\left(mol\right)\)
\(3Fe+2O_2\rightarrow Fe_3O_4\)
0,03 ..0,02 ...... 0,01 (mol)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03.56=1,68\left(g\right)\\V_{O_2}=0,02.22,4=0,448\left(l\right)\end{matrix}\right.\)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
0,04 ------------------------------------ 0,02 (mol)
\(\rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)
a)PTHH: 3Fe+2O2__>Fe3O4
SỐ MOL OXIT SẮT TỪ:2.32/232=0.1MOL
THEO PT:
- ĐỂ TẠO RA 1 MOL Fe3O4 CẦN 2 MOL O2 VẬY ĐỂ TẠO RA 0.1 MOL Fe3O4 CẦN 0.2 MOL O2
- ĐỂ TẠO RA 1 MOL Fe3O4 CẦN 3 MOL Fe VẬY ĐỂ TẠO RA 0.1 MOL Fe3O4 CẦN 0.3 MOL Fe
=>SỐ GAM Fe CẦN: 0.3x56=16.8 g
-THỂ TÍCH KHÍ O2 CẦN: 0.2x22.4=4.48 l
b) PTHH: 2KMnO4 __>MnO2+O2+K2MnO4
Theo PT,để tạo 1 mol O2 cần 2 mol KMnO4
⇒để tạo ra 0.2 mol O2(cần dùng) thì cần 0.4 mol KMnO4
⇒ số g KMnO4 cần là:158*0.4=63.2
P/S: đúng thì nhớ tích vào đấy
\(n_{Fe_3O_4}=\dfrac{2.32}{232}=0.01\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.03.....0.02......0.01\)
\(m_{Fe}=0.03\cdot56=1.68\left(g\right)\)
\(m_{O_2}=0.02\cdot32=0.64\left(g\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(m_{KMnO_4}=0.02\cdot2\cdot158=6.32\left(g\right)\)