Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)

Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
nH2S = nMgS = nS = 0,15 mol;
nH2= nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
=> MY = (0,15.34+0,05.2)/(0,15+0,05)=26

Đáp án B
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol), nS = 0,15 9mol)
nH2S = nMgS = nS = 0,15 mol;
nH2 = nMg (dư) = 0,2 – 0,15 =0,05 (mol)
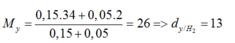
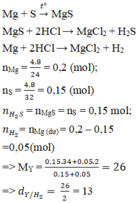
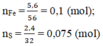
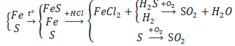

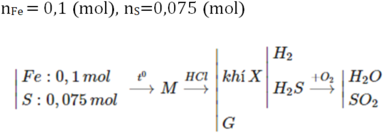

Do hòa tan X vào dd HCl dư thu được hỗn hợp khí
=> Trong X chứa Fe
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\); \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,2<-0,2---->0,2
Fe + 2HCl --> FeCl2 + H2
0,1------------------->0,1
FeS + 2HCl --> FeCl2 + H2S
0,2---------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=\dfrac{0,2}{0,1+0,2}.100\%=66,67\%\end{matrix}\right.\)
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
LTL: 0,3 > 0,2 => Fe dư
Theo pthh: nFe (pư) = nS = nFeS = 0,2 (mol)
=> nFe (dư) = 0,3 - 0,2 = 0,1 (mol)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,1------------------------->0,1
FeS + 2HCl ---> FeCl2 + H2S
0,2--------------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=100\%-33,33\%=66,67\%\end{matrix}\right.\)