Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,1<-0,05<-------0,1
2CO + O2 --to--> 2CO2
0,2<--0,1-------->0,2
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\V_{CO}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
b) \(m_{CO_2}=0,2.44=8,8\left(g\right)\)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1mol\)
\(2CO+O_2\rightarrow2CO_2\)
a 0,5a a
\(2H_2+O_2\rightarrow2H_2O\)
0,1 0,05 \(\leftarrow\) 0,1
\(\Sigma n_{O_2}=0,5a+0,05=0,15\)
\(\Rightarrow a=n_{O_2\left(CO\right)}=0,2mol\)
\(V_{CO}=2\cdot0,2\cdot22,4=8,96l\)
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{CO_2}=0,2\cdot44=8,8g\)

Sơ đồ X + O 2 → C O 2 + H 2 O ( 1 )
Áp dụng định luật bảo toàn khối lượng cho sơ đồ (1), ta có :
m + m O 2 = m C O 2 + m H 2 O
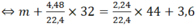
⇔ m = 1,6 gam

Câu 1 :
\(n_X=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{CO_2}=\dfrac{12.32}{22.4}=0.55\left(mol\right)\)
\(\Rightarrow n_C=0.55\left(mol\right)\)
\(n_{H_2O}=\dfrac{10.8}{18}=0.6\left(mol\right)\)
\(\Rightarrow n_H=0.6\cdot2=1.2\left(mol\right)\)
\(m_X=m_C+m_H=0.55\cdot12+1.2=7.8\left(g\right)\)
\(\overline{M}_X=\dfrac{7.8}{0.15}=52\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{X}{H_2}}=\dfrac{52}{2}=26\)
Câu 2 :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Al}=\dfrac{a}{27}\left(mol\right)\)
\(n_{Fe}=\dfrac{a}{56}\left(mol\right)\)
Để cân thăng bằng thì lượng khí H2 thoát ra phải như nhau.
Vì :
\(n_{Fe}=\dfrac{a}{56}< n_{Al}=\dfrac{a}{27}\left(mol\right)\)
và lượng H2 sinh ra ở cả 2 phản ứng trên phụ thuộc vào HCl là như nhau
Để cân thăng bằng thì lượng HCl cho vào không vượt quá lượng tối đa để hòa tan Fe
\(n_{HCl}=2n_{Fe}=\dfrac{2a}{56}\left(mol\right)\)
\(\Rightarrow b\le\dfrac{2a}{56}\)

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

\(V_{CO_2}=0,5.22,4=11,2\left(l\right)\)
\(A_{CO_2}=0,5.6.10^{23}=3.10^{23}\) (phân tử \(CO_2\) )
2.
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(n_C=n_{CO_2}=0,1\left(mol\right)\) (1)
=> \(n_O=2nCO_2=0,1.2=0,2\left(mol\right)\) (*)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
=> \(n_H=2n_{H_2O}=0,2.2=0,4\left(mol\right)\) (2)
=> \(n_O=n_{H_2O}=0,2\left(mol\right)\) (**)
\(n_{O_2}=\dfrac{4,8}{22,4}=0,2\left(mol\right)\)
=> \(n_O=2n_{O_2}=2.0,2=0,4\left(mol\right)\) (3)
\(X+O_2\underrightarrow{t^o}CO_2+H_2O\)
Từ (1),(2),(3), (*), (**) suy ra: \(n_C:n_H:n_O=0,1:0,4:0\)
=> Công thức tổng quát của X là \(C_xH_y\)
có: \(x:y=n_C:n_H=0,1:0,4=1:4\)
=> X là: \(CH_4\)
Sơ đồ pứ: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(m_{CH_4}=3,6+0,2.44-0,2.32=6\left(g\right)\)

a)
2CO + O2 --to--> 2CO2
2H2 + O2 --to--> 2H2O
b) \(n_{H_2O}=\dfrac{12,6}{18}=0,7\left(mol\right)\); \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
0,6<--0,3<------0,6
2H2 + O2 --to--> 2H2O
0,7<--0,35<------0,7
=> \(\left\{{}\begin{matrix}V_{CO}=0,6.22,4=13,44\left(l\right)\\V_{H_2}=0,7.22,4=15,68\left(l\right)\end{matrix}\right.\)
VO2 = (0,3 + 0,35).22,4 = 14,56 (l)
c) \(M_A=\dfrac{0,6.28+0,7.2}{0,6+0,7}=14\left(g/mol\right)\)
=> \(d_{A/O_2}=\dfrac{14}{32}=0,4375\)

Câu 20:
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{matrix}\right.\) ⇒ 65x + 64y = 12,9 (1)
PT: \(2Zn+O_2\underrightarrow{t^o}2ZnO\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
THeo PT: \(n_{O_2}=\dfrac{1}{2}n_{Zn}+\dfrac{1}{2}n_{Cu}=\dfrac{1}{2}x+\dfrac{1}{2}y=\dfrac{2,24}{22,4}=0,1\left(mol\left(2\right)\right)\)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{12,9}.100\%\approx50,39\%\\\%m_{Cu}\approx49,61\%\end{matrix}\right.\)

PT: \(C_4H_{10}+\dfrac{13}{2}O_2\underrightarrow{t^o}4CO_2+5H_2O\)
\(C_6H_{14}+\dfrac{19}{2}O_2\underrightarrow{t^o}6CO_2+7H_2O\)
Ta có: \(n_{C_4H_{10}}+n_{C_6H_{14}}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=4n_{C_4H_{10}}+6n_{C_6H_{14}}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_4H_{10}}=0,025\left(mol\right)\\n_{C_6H_{14}}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{hh}=m_{C_4H_{10}}+m_{C_6H_{14}}=5,75\left(g\right)\)
\(\left\{{}\begin{matrix}\%n_{C_4H_{10}}=\dfrac{0,025}{0,025+0,05}.100\%\approx33,33\%\\\%n_{C_6H_{14}}\approx66,67\%\end{matrix}\right.\)

Ta có tổng cộng \(2\) \(PTHH\) sau:
\(1\)) \(CH4+2O2\overset{t^o}{\rightarrow}CO2+2H2O\)
\(2\)) \(2H2+O2\overset{t^o}{\rightarrow}2H2O\)
Có \(nCO2=\dfrac{2,24}{22,4}=0,1mol\)
Dựa vào \(PTHH1\)) \(nCO2=nCH4=0,1mol\)
Vậy \(mCH4=0,1.16=1,6g\)
Có \(nH2O=\dfrac{6,3}{18}=0,35mol\)
Ta thấy ở \(PTHH1\)) \(nH2O=2nCO2=0,1.2=0,2mol\)
Vậy số mol của \(H_2O\) ở \(PTHH2\) là \(0,35-0,2=0,15mol\)
Dựa vào \(PTHH2\)) \(nH2=nH2O=0,15mol\)
Vậy \(mH2=0,15.2=0,3g\)