Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1.1 : Muối gồm NaHCO3(y mol) ; n Na2CO3(x mol)
Ta có :
106x + 84y = 42,2
2x + y = 0,65.2
=> x = 0,2 ; y = 0,25
=> n CO2 = x + y = 0,45(mol)
m H2O = 29,7 - 0,45.44 = 9,9(gam)
n H2O = 9,9/18 = 0,55(mol)
Gọi n CH4 = a(mol) ; n C2H4 = b(mol) ; n C2H2 = c(mol)
Ta có:
a + b + c = 0,3
a + 2b + 2c = 0,45
2a + 2b + c = 0,55
=> a = 0,15 ; b = 0,1 ; c = 0,05
%V CH4 = 0,15/0,3 .100% = 50%

Câu 1:
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}n_{CuO}=n_{Cu}=b\left(mol\right)\\n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=\dfrac{1}{2}a\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow102\cdot\dfrac{1}{2}a+80b=21,1\) (1)
Ta có: \(n_{O_2}=\dfrac{3,92}{22,4}=0,175\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,1\cdot27=2,7\left(g\right)\\m_{Cu}=0,2\cdot64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{2,7}{2,7+12,8}\cdot100\%\approx17,42\%\\\%m_{Cu}=82,58\%\end{matrix}\right.\)

Gọi số mol metan, etilen và axetilen trong X lần lượt là x, y, z.
\(\Rightarrow16x+28y+26z=8,6\)
Cho hỗn hợp X qua dung dịch brom dư
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
\(\Rightarrow n_{Br2}=n_{C2H4}+2n_{C2H2}=y+2z=\frac{48}{80.2}=0,3\left(mol\right)\)
Giả sử lượng 13,44 lít X gấp k lần lượng trên
\(\Rightarrow k.\left(x+y+z\right)=\frac{13,44}{22,4}=0,6\left(mol\right)\)
Cho hỗn hợp tác dụng với AgNO3/NH3
\(C_2H_2+2AgNO_3+2NH_3\rightarrow Ag_2C_2+2NH_4NO_3\)
\(\Rightarrow n_{Ag2C2}=n_{C2H2}=kz=\frac{36}{108.2+12.2}=0,15\left(mol\right)\)
\(\Rightarrow\frac{kz}{k\left(x+y+z\right)}=\frac{0,16}{0,6}\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\\z=0,1\end{matrix}\right.\)
Vì % số mol = % thể tích
\(\Rightarrow\%V_{CH4}=\frac{0,2}{0,2+0,1+0,1}=50\%\)

Đáp án D
Số mol của SO2 thu được là: n SO 2 = 1 , 6 mol
Đặt số mol các chất trong A là FeS2: a mol; ZnS : b mol
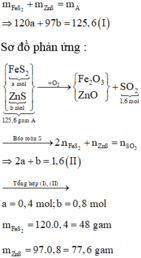

Đáp án B
Fe là kim loại yếu hơn Al =>Al phản ứng trước, Fe phản ứng sau => 2,4 gam kim loại chính là Fe dư
Gọi số mol các chất là Al: a mol; Fe (pứ): b mol
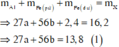
KMnO4 là chất oxi hoá mạnh, trong môi trường axit sẽ oxi hoá Fe + 2 lên Fe + 3 , Cl - 1 lên Cl 2 0 và bản thân Mn + 7 bị khử xuống Mn + 2
Như vậy, khi xét cả quá trình thì chỉ có Al, Fe và KMnO4 thay đổi số oxi hoá:
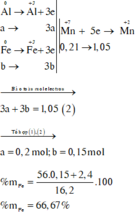

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

BTNT " C và H" ta có:
\(n_{CH4}+2n_{C2H2}=n_{CO2}=\frac{35,2}{44}\)
\(4n_{CH4}+2n_{C2H2}=2n_{H2}=\frac{16,2}{18}.2\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CH4}=\frac{1}{33}\\n_{C2H2}=\frac{7}{30}\end{matrix}\right.\)
\(\%m_{CH4}=\frac{\frac{1}{3}.16}{\frac{1}{3}.16+\frac{7}{30}.26}.100\%=46,78\%\)