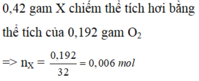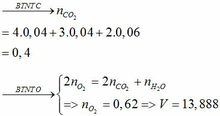Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)

CxH2x +2 + (3x+1)/2O2 → t ∘ x CO2 + (x+1) H2O
CyH2y + 3y/2O2 → t ∘ y CO2 + y H2O
CzH2z-2 + (3z-1)/2O2 → t ∘ zCO2 + (z-1) H2O
Khi đốt cháy hỗn hợp A thu được CO2 và H2O. Cho sản phẩm qua Ca(OH)2 dư thì khối lượng bình tăng chính là khối lượng của H2O và CO2
=> mCO2 + mH2O = 9,56 (g)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 16/100 = 0,16 (mol)
=> nH2O = (9,56 – 0,16.44)/18 = 0,14 (mol)
Ta có hệ phương trình:
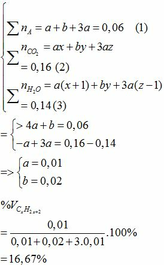
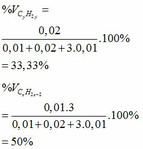
b)
thế a, b vào (2) => 0,01x + 0,02y + 3.0,01z = 0,16
=> x + y +3z = 16
Vì có 2 hidrocacbon bằng nhau và bằng một nửa số cacbon của hidrocacbon còn lại nên có các trường hợp sau:
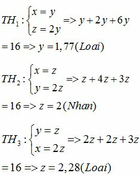
Vậy công thức phân tử của 3 hidrocacbon là: C2H6; C2H4 và C2H2

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%

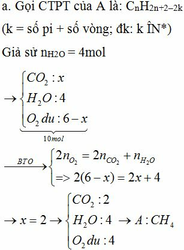
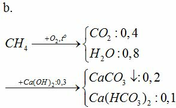
pt:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,3 → 0,3 0,3
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,1 → 0,1 0,1
m dd tăng = mCO2 + mH2O – mCaCO3 = 12g