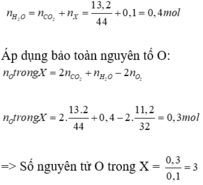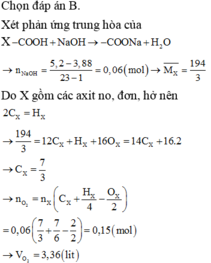Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt CTHH của X là
\(C_nH_{2n+1}COOH\)
\(n_{C_nH_{2n+1}COOH}=\dfrac{2,55}{14n+46}\left(mol\right);n_{CO_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
BTNT C: \(n_{CO_2}=\left(n+1\right).n_{C_nH_{2n+1}COOH}=\dfrac{2,55.\left(n+1\right)}{14n+46}=0,125\)
\(\Rightarrow n=4\)
Vậy X là \(C_4H_9COOH\)

\(n_{O_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(C_nH_{2n}O_2+\left(1.5n-1\right)O_2\underrightarrow{^{t^0}}nCO_2+nH_2O\)
\(\dfrac{0.5}{1.5n-1}..........0.5\)
\(M=14n+32=\dfrac{8.8}{\dfrac{0.5}{1.5n-1}}=17.6\cdot\left(1.5n-1\right)\)
\(n=4\)
\(CT:C_3H_7COOH\)

Đáp án B
Hướng dẫn Gọi X có dạng CnH2nO2
CnH2nO2 → CnH2n-1O2Na = > 3 , 88 14 n + 32 = 5 , 2 14 n + 54 = > n = 7 / 3
=> nCnH2nO2 = nCnH2n-1O2Na = (5,2 – 3,88) / 22 = 0,06 mol
Đốt cháy hỗn hợp X thu được nCO2 = nH2O = n.nCnH2nO2 = 0,06n = 0,06.7/3 = 0,14 mol
Bảo toàn O: nO trong axit + 2.nO2 = 2.nCO2 + nH2O
=> nO2 = (0,14.3 – 0,06.2) / 2 = 0,15 mol
=> V = 3,36 lít