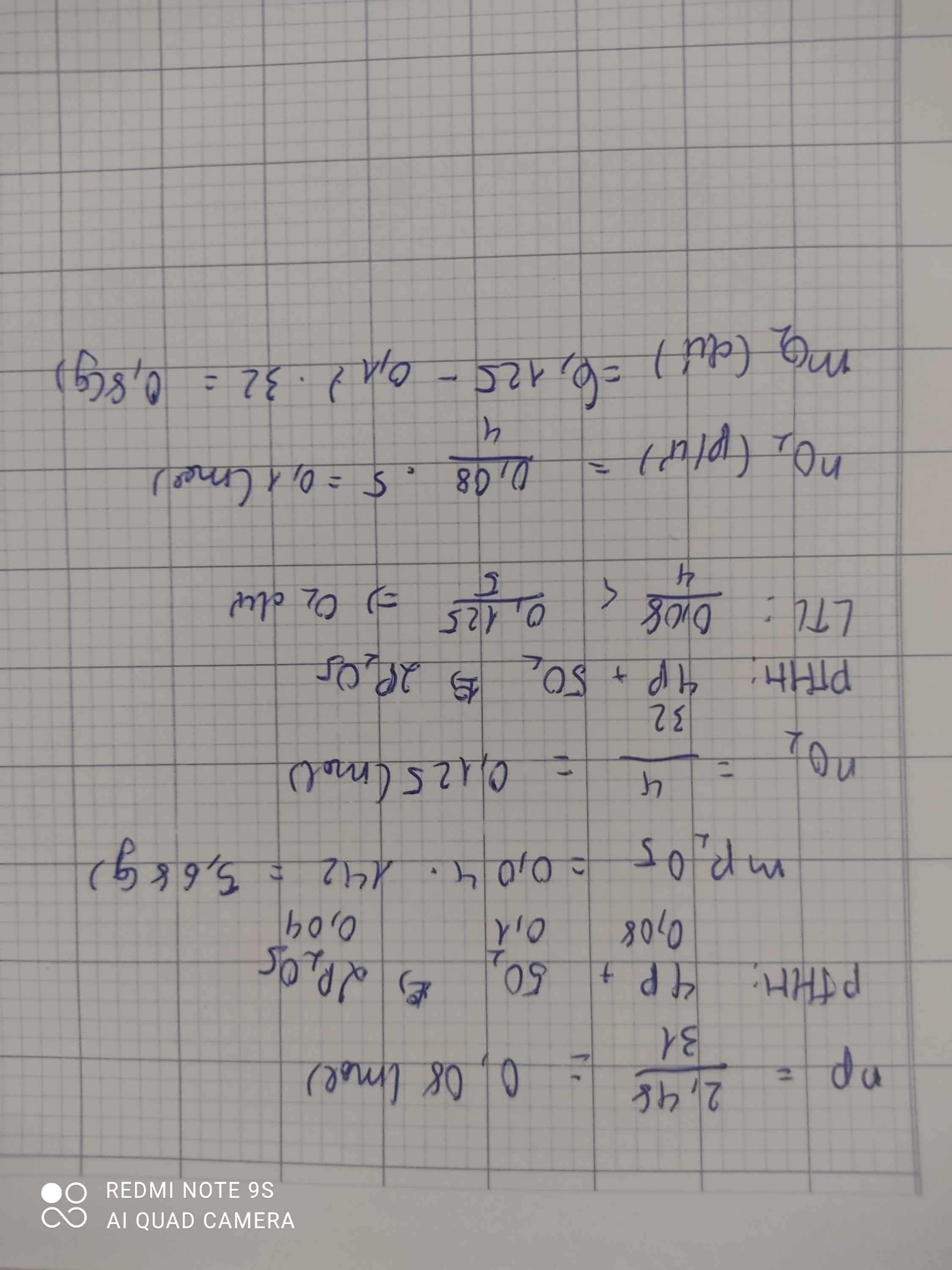Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 3Fe + 2O2 --to--> Fe3O4
Sô nguyên tử Fe: số phân tử O2 : số phân tử Fe3O4 = 3:2:1
b) \(n_{Fe}=\dfrac{25,2}{56}=0,45\left(mol\right)\)
3Fe + 2O2 --to--> Fe3O4
0,45->0,3--------->0,15
=> mFe3O4 = 0,15.232 = 34,8 (g)
=> VO2 = 0,3.22,4 = 6,72(l)

\(a,PTHH:2Zn+O_2\rightarrow^{t^o}2ZnO\\ b,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ \Rightarrow n_{O_2}=\dfrac{1}{2}n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{O_2}=0,1\cdot32=3,2\left(g\right)\\ c,\text{Bảo toàn KL: }m_{ZnO}=m_{O_2}+m_{Zn}=3,2+13=16,2\left(g\right)\)

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{50,4}{2.22,4}=0,45\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
LTL: \(\dfrac{0,2}{4}< \dfrac{0,45}{5}\rightarrow\) O2 dư
Theo pthh: \(\left\{{}\begin{matrix}n_{Al_2O_3}=\dfrac{0,2}{2}=0,1\left(mol\right)\\n_{O_2\left(pư\right)}=\dfrac{3}{4}.0,2=0,15\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{O_2\left(dư\right)}=\left(0,45-0,15\right).32=9,6\left(g\right)\\m_{Al_2O_3}=0,1.102=10,2\left(g\right)\end{matrix}\right.\)

Theo đề ta có a+b = 5
Lưu huỳnh có 3 hoá trị II, IV và VI
Nếu S(VI) => a + b > 5 (loại)
Nếu S(IV)
=> công thức hoá học có dạng R4S
Theo cách tính PTK ta có:
4MR + 32 = 150
=> MR = 29,5 (ko có)
Vậy S(II)
=> công thức hoá học có dạng R2S3
Theo cách tính PTK ta có:
2MR + 32.3 = 150
=> MR = 27 (Al)
Vậy công thức hoá học hợp chất là Al2S3

nP = 2,48/31 = 0,08 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 ---> 0,1 ---> 0,04
mP2O5 = 0,04 . 142 = 5,68 (g)
b) nO2 = 4/32 = 0,125 (mol)
So sánh: 0,125 > 0,1 => O2 dư
nO2 (dư) = 0,125 - 0,1 = 0,025 (mol)
mO2 (dư) = 0,025 . 32 = 0,8 (g)