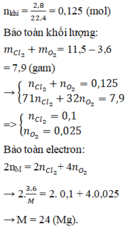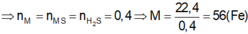Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
Phương trình phản ứng
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,4 0,2 0,8 mol
![]()
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
0,2 0,6 mol
m = 0,4 × 120 = 48g
![]()

Đáp án D
n O 2 = 0 , 9 ( m o l ) , n S O 2 = 0 , 8 ( m o l )
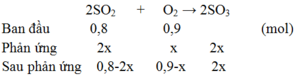
n sau phản ứng là:
1,7-x = 1,7 – x
=> x = 0,25 (mol)

Đáp án C.
Gọi x là số mol oxi đã phản ứng, ta có:
Tổng số mol khí trước phản ứng là: 3 + 2 = 5 mol
Tổng số mol khí sau phản ứng là: 5 – x
![]()
Xét tỉ lệ giữa số mol và hệ số cân bằng của SO2 và O2, SO2 hết, O2 dư
![]()

Chọn A
Cách 1:
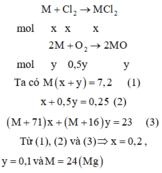
Cách 2:
Gọi số mol của Cl2 và O2 phản ứng lần lượt là x và y mol
→ nkhí = 0,25 mol → x + y = 0,25 (1)
Bảo toàn khối lượng có mkhí= 23 – 7,2= 15,8 gam
→ 71x + 32y = 15,8 (2)
Từ (1) và (2) → x = 0,2 và y = 0,05
Bảo toàn electron có:
2.nM = 2.nCl2 + 4.nO2 → nM= 0,3 → MM = 7,2 : 0,3 = 24 (g/mol)
Vậy kim loại M là Mg.

Đáp án A
mrắn sau − mM = mX ⇒ 71nCl2 + 32nO2 = 23 − 7,2 = 15,8 g (1)
⇒nkhí = nCl2 +nO2 = 0,25 mol (2)
Giải hệ (1) và (2) ⇒nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
Bảo toàn e

M = ![]() = 12x, x = 2 => M = 24 (Mg)
= 12x, x = 2 => M = 24 (Mg)