Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, (1) 4P+5.O2->2.P2O5
(2) P2O5+4.NaOH->2.Na2HPO4+H2O
b, photpho có n=6,2:31=0,2 mol.dựa theo pt (1) thấy nP2O5=0,1mol.theo pt (2) thấy nNaOH=0,4mol vậy mNaOH=0,4.40=16 g vậy m(dd NaOH)=16:32%=50 g
c, theo pt (2) nNa2HPO4 =0,2 mol vậy mNa2HPO4=0,2.142=28,4 g
m(dd sau pư)=mP+m(dd NaOH)=6,2+50=56,2 g
=> C%(dd Na2HPO4)=28,4:56,2=50,53%

Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2
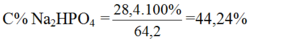

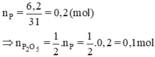
Theo pt: nNaOH = 4. nP2O5 = 4. 0,1 = 0,4 mol
Khối lượng NaOH = 0,4. 40 = 16 g
Khối lượng dung dịch NaOH = 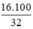 = 50,0 g
= 50,0 g

a) 4P + 5O2 \(\underrightarrow{t^0}\)t0 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b) Số mol P tham gia phản ứng: \(\dfrac{6,20}{31,0}=0,200\left(mol\right)\) (mol)
Từ (1) và (2) có sơ đồ hợp thức:
2P → P2O5 → 4NaOH → 2Na2HPO4 (3)
2 mol 1 mol 4 mol 2 mol
0,200 mol 0,100 mol 0,400 mol 0,200 mol
Từ đó tính được số gam dung dịch NaOH 32,0 % đã dùng là 50,0 gam.
c) Dựa vào (3) tính được 0,200 mol Na2HPO4.
MddNa2HPO4 = 14,2 gam + 50,0 gam = 64,2 (g)
C% dd Na2HPO4 = … x 100% = 44,2 %

Đáp án: A.
Hướng dẫn:
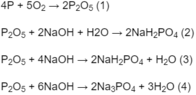
Số mol photpho: 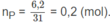
Số mol NaOH: ![]()
Sản phẩm tạo thành khi đốt photpho là P 2 O 5 .
Theo (1), số mol P 2 O 5 :
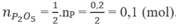
Ti lệ số mol NaOH và P 2 O 5 :
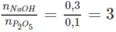
Tỉ lệ số mol nằm trong khoảng 2 và 4, do đó theo các phản ứng (2) và (3) trong dung dịch thu được có hai muối được tạo thành là N a H 2 P O 4 và N a 2 H P O 4 .
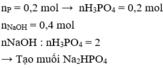



Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)