Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
nCO2= 0,1 ; nH2O = 0,14
BTNT O => nO2 = ( 0,1.2 + 0,14) : 2 = 0,17 (mol) => VO2 = 0,17.22,4 = 3,808 lít

n H 2 O = n CO 2 = 0,0195 mol → loại đáp án D.
- X có phản ứng với Cu ( OH ) 2 trong môi trường kiềm khi đun nóng → X là C 2 H 5 CHO thỏa mãn.
- Chọn đáp án A.

Đáp án D
Phương pháp: Bảo toàn nguyên tố
Hướng dẫn giải:
nCO2 = 0,14
nH2O = 0,12
Bảo toàn O
2nO2 = 2nCO2 + nH2O = 0,4mol
=> nO2 = 0,2 => V = 4,48 lít

Đáp án là D
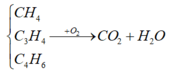
Ta có:
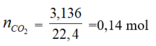
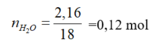
bảo toàn nguyên tố O ta có : no( trong O2)=
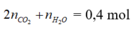
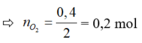
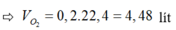

Đáp án A
metan, propin và buta -1,3 – đien → là hợp chất hidro cacbon
→ thành phần chỉ có C, H
![]()
Vậy:
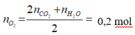
→ V = 4,48 lít

nCO2 = \(\dfrac{6,72}{22,4}\)= 0,3 mol , nH2O = \(\dfrac{5,4}{18}\)= 0,3 mol
=> mC = 0,3.12 = 3,6 gam , mH = 2nH2O . 1 = 0,6gam
mC + mH = 4,2g < mA => Trong A ngoài C và H còn có Oxi
mO = 5,8 - 4,2 = 1,6 gam <=> nO = 1,6/16 = 0,1 mol
Gọi CTĐGN của A là CxHyOz
Ta có x:y:z = nC:nH:nO = 3:6:1 => CTPT của A là (C3H6O)n
2,32 g A có thể tích = 1/3 thể tích 1,92 gam O2 ở cùng điều kiện
=> 2,32 g A có số mol = 1/3 số mol của 1,92 gam O2 = \(\dfrac{1,92}{32.3}\)= 0,02mol
<=> MA = \(\dfrac{2,32}{0,02}\)= 116(g/mol)
=> n = 2 và CTPT của A là C6H12O2
b) B tác dụng được với KOH, CaCO3 => B là axit cacboxylic
CH3-(CH2)4-COOH

\(nA=\dfrac{0,3}{30.2}=0,005\left(mol\right)\)
\(nCO_2=0,01\left(mol\right)\)
\(nH_2O=0,01\left(mol\right)\)
\(\Rightarrow A:C_2H_4O_2\) ( CTPT của A)
Vì A phản ứng với Na tạo H2 và có phản ứng tráng bạc nên A có công thức cấu tạo là \(HO-CH_2-CHO\)
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)=n_C;n_H=2n_{H_2O}=2.\dfrac{1,8}{18}=0,2\left(mol\right)\)
\(\Rightarrow m_C=0,1.12=1,2\left(g\right);m_H=0,2.1=0,2\left(g\right)\Rightarrow m_O=3-1,2-0,2=1,6\left(g\right)\)
\(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\Rightarrow x:y:z=0,1:0,2:0,1=1:2:1\Rightarrow\left(CH_2O\right)_n\)
\(n\left(12+2+16\right)=30.2=60\Rightarrow n=2\Rightarrow C_2H_4O_2\)
BTNT oxi: \(2.n_{CO_2}+n_{H_2O}=0,1+n_{O< trong-khong-khi>}\Rightarrow n_O=0,2\left(mol\right)\)
Nhớ ko nhầm thì oxi chiếm 20% thể tích ko khí thì phải
\(\Rightarrow V_{kk}=\dfrac{22,4.0,2}{0,2}=22,4\left(l\right)\)
Ơ mà hình như nhầm chỗ Vkk rồi. Phải là bằng 22,4.0,1/0,2 mới đúng. Đây là phân tử oxi chứ ko phải nguyên tố nữa