Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a/ \(2CO\left(0,2\right)+O_2\left(0,1\right)\rightarrow2CO_2\left(0,2\right)\)
\(2H_2\left(0,1\right)+O_2\left(0,05\right)\rightarrow2H_2O\left(0,1\right)\)
\(n_{H_2O}=\frac{1,8}{18}=0,1\)
\(n_{O_2}=\frac{3,36}{22,4}=0,15\)
Số mol O2 phản ứng ở phản ứng đầu là: \(0,15-0,05=0,1\)
\(\Rightarrow m_{CO_2}=0,2.44=8,8\)
b/ \(m_{CO}=0,2.28=5,6\)
\(m_{H_2}=0,1.2=0,2\)
c/ \(\%CO=\frac{0,2}{0,3}.100\%=66,67\%\)
\(\Rightarrow\%H_2=100\%-66,67\%=33,33\%\)

câu 1: nAl=0,4 mol
mHCL=54,75g=> nHCl=1,5 mol
PTHH: 2Al+6HCl=> 2AlCl3+3H2
0,4mol: 1,5mol => nHCl dư theo nAl
0,4mol-->1,2 mol-->0,4mol-->0,6mol
thể tích H2 là V=0,6.22,4=13,44ml
b) theo định luật btoan khối lượng ta có : mAlCl3=200+10,8-0,6.2=209,6g
m AlCl3=0,4.(27+35,5.3)=53,4g
=> C% AlCl3= 25,48%
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Khối lượng chất tan HCl là:
200 . 27,375% = 54,75(gam)
Số mol của HCl là: 54,75 : 36,5 = 1,5 (mol)
Số mol của Al là: 10,8 : 27 = 0,4 (mol)
So sánh: \( {0,4{} \over 2}\) < \({1,5} \over 6\)
=> HCl dư, tính theo Al
Số mol của khí hiđrô sinh ra là: 0,4 . \(3 \ \over 2\) = 0,6 (mol)
V= 0,6 . 22,4 = 13,44 (lít)
Sau đó áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch A:
Khối lượng nhôm + Khối lượng dung dịch axit
= Khối lượng dung dịch A + khối lượng khí hiđrô
<=> Khối lượng dung dịch A là:
10,8 + 200 - 0,6 . 2 = 209,6 (gam)
Khối lượng chất tan AlCl3 trong dung dịch A là:
0,4 . 133,5 = 53,4 (gam)
C% chất tan trong dung dịch A là:
( 53,4 : 209,6 ) . 100% = 25,48%

Sai đề rồi hay sao á bạn, sửa 49,6l thành 89,6l nhé!
a. PTHH: \(2H_2+O_2\rightarrow2H_2O\\ xmol:\dfrac{x}{2}mol\rightarrow xmol\)
\(2CO+O_2\rightarrow2CO_2\\ ymol:\dfrac{y}{2}mol\rightarrow ymol\)
b. Gọi x là số mol của \(H_2\) , y là số mol của \(CO\)
\(m_{hh}=m_{H_2}+m_{CO}\Leftrightarrow2x+28y=68\left(g\right)\left(1\right)\)
\(n_{O_2}=\dfrac{89,6}{22,4}=4\left(mol\right)\Leftrightarrow\dfrac{x}{2}+\dfrac{y}{2}=4\left(mol\right)\)
\(\Leftrightarrow x+y=8\left(2\right)\)
Giải (1) và (2) ta được: \(\left\{{}\begin{matrix}x=6\\y=2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}V_{H_2}=22,4.6=134,4\left(l\right)\\V_{CO}=22,4.2=44,8\left(l\right)\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{134,4}{134,4+44,8}.100\%=75\%\\V_{CO}=25\%\end{matrix}\right.\)

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
Gọi \(\left\{{}\begin{matrix}n_C=x\\n_S=y\end{matrix}\right.\)
\(C+O_2\rightarrow\left(t^o\right)CO_2\)
x x ( mol )
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}12x+32y=2,8\\x+y=0,15\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\rightarrow m_C=0,1.12=1,2g\)
\(\rightarrow m_S=0,05.32=1,6g\)
\(\rightarrow\left\{{}\begin{matrix}\%m_C=\dfrac{1,2}{2,8}.100=42,85\%\\\%m_S=100\%-42,85\%=57,15\%\end{matrix}\right.\)
Gọi \(\left\{{}\begin{matrix}n_C=a\left(mol\right)\\n_S=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
C + O2 --to--> CO2
a--->a
S + O2 --to--> SO2
b--->b
=> \(\left\{{}\begin{matrix}12a+32b=2,8\\a+b=\dfrac{3,36}{22,4}=0,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_C=0,1.12=1,2\left(g\right)\\m_S=0,05.32=1,6\left(g\right)\end{matrix}\right.\)

Đặt \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{Fe_2O_3}=y\left(mol\right)\end{matrix}\right.\)
\(m_{CuO}+m_{Fe_2O_3}=40\\ \Rightarrow80x+160y=40\left(1\right)\)
\(PTHH:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\ \left(mol\right)......x\rightarrow.x\\ PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ \left(mol\right).....y\rightarrow....3y\\ V_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ \Rightarrow x+3y=0,6\left(2\right)\)
\(\xrightarrow[\left(2\right)]{\left(1\right)}\left\{{}\begin{matrix}80x+160y=40\\x+3y=0,6\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,1\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}m_{CuO}=80.0,3=24\left(g\right)\\m_{Fe_2O_3}=40-24=16\left(g\right)\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{24}{40}.100\%=60\%\\\%m_{Fe_2O_3}=100\%-60\%=40\%\end{matrix}\right.\)

a)
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
$S + O_2 \xrightarrow{t^o} SO_2$
b) Gọi $n_P = a(mol) ; n_S = b(mol) \Rightarrow 31a + 32b = 15,6(1)$
Theo PTHH :
$n_{O_2} = \dfrac{5}{4}n_P + n_S = \dfrac{5a}{4} + b = \dfrac{13,44}{22,4} = 0,6(2)$
Từ (1)(2) suy ra : a = 0,4 ; b = 0,1
$m_P = 0,4.31 = 12,4(gam)$
$m_S = 0,1.32 = 3,2(gam)$
c) $n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol) \Rightarrow m_{P_2O_5} = 0,2.142 = 28,4(gam)$
$n_{SO_2} = n_S = 0,1(mol) \Rightarrow V_{SO_2} = 0,1.22,4 = 2,24(lít)$

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(2Zn+O_2\underrightarrow{t^o}2ZnO|\)
2 1 2
a 0,5b 0,2
\(2Mg+O_2\underrightarrow{t^o}2MgO|\)
2 1 2
b 0,5b 0,1
a) Gọi a là số mol của Zn
b là số mol của Mg
\(m_{Zn}+m_{Mg}=15,4\left(g\right)\)
⇒ \(n_{Zn}.M_{Zn}+n_{Mg}.M_{Mg}=15,4g\)
⇒ 65a + 24b = 15,4g (1)
Theo phương trình : 0,5a + 0,5b = 0,15 (2)
65a + 24b = 15,4g
0,5a + 0,5b = 0,15
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(m_{Zn}=0,2.65=13\left(g\right)\)
\(m_{Mg}=01.24=2,4\left(g\right)\)
b) Có : \(n_{ZnO}=\dfrac{0,2.2}{2}=0,2\left(mol\right)\)
⇒ \(m_{ZnO}=0,2.81=16,2\left(g\right)\)
\(n_{MgO}=\dfrac{0,1.2}{2}=0,1\left(mol\right)\)
⇒ \(m_{MgO}=0,1.40=4\left(g\right)\)
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn sửa chỗ ' nH2 ' thành ' nO2 ' giúp mình
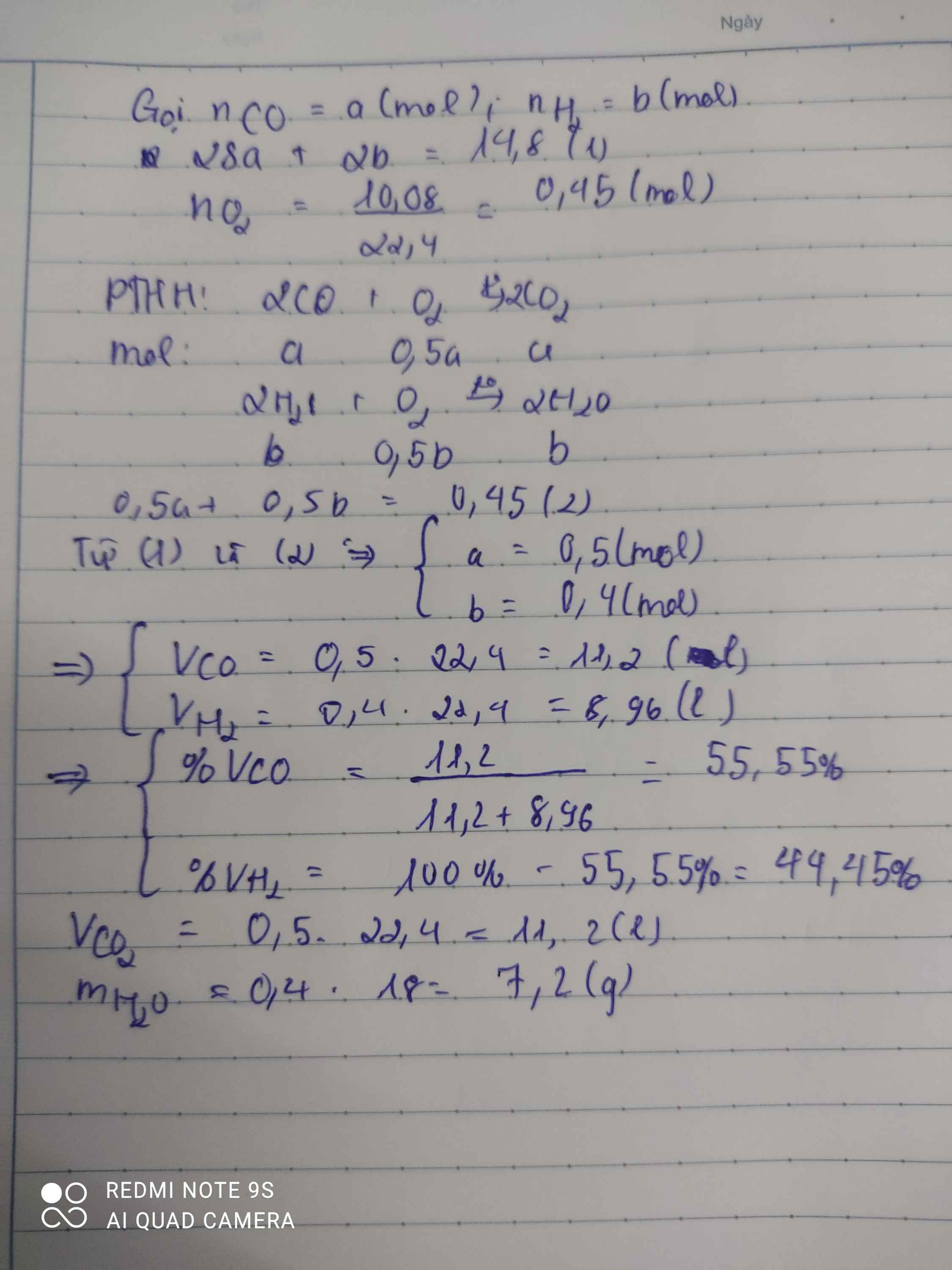
nO2=3.36/22.4=0.15(mol)
Gọi x, y lần lượ là số mol của C và S ( x,y >0)
C+O2-> (t°) CO2
x->x-> x
S + O2 ->(t°) SO2
y-> y-> y
Ta có hpt
12x + 32y =2.8
x+y =0.15
=> x=0.1, y =0.05
mC= 0.1×12=1.2(g)
mS= 0.05×32=1.6(g)