Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)

Câu 1:
a) - Điều chế O2:
.........2KClO3 --to--> 2KCl + 3O2
- Điều chế ZnO:
..........2Zn + O2 --to--> 2ZnO
- Điều chế H2, FeSO4:
..........Fe + H2SO4 (loãng) --> FeSO4 + H2
b) Pt: 2KClO3 --to--> 2KCl + 3O2
- Điều chế Al2O3:
..........4Al + 3O2 --to--> 2Al2O3
- Điều chế SO2:
...........S + O2 --to--> SO2
- Điều chế Fe3O4:
...........3Fe + 2O2 --to--> Fe3O4
c) - Điều chế H2:
............Zn + H2SO4 (loãng) --> ZnSO4 + H2
- Điều chế O2:
...........2KMnO4 --to--> K2MnO4 + MnO2 + O2
- Điều chế H2O:
...........2H2 + O2 --to--> 2H2O
- Điều chế H3PO4:
...........4P + 5O2 --to--> 2P2O5
...........P2O5 + 3H2O --> 2H3PO4
Câu 2:
nAlCl3 = \(\dfrac{26,7}{133,5}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + ....3H2
0,2 mol<----------- 0,2 mol-> 0,3 mol
mAl pứ = 0,2 . 27 = 5,4 (g)
VH2 = 0,3 . 22,4 = 6,72 (lít)
nH2O = \(\dfrac{9}{18}=0,5\) mol
Pt: .....2H2 + O2 --to--> 2H2O
...0,3 mol-------------> 0,3 mol
...CH4 + 2O2 --to--> CO2 + 2H2O
0,1 mol<--------------------(0,5 - 0,3) mol
VCH4 cần dùng = 0,1 . 22,4 = 2,24 (lít)

CH4 + 2O2 \(\rightarrow\)CO2 + 2H2O (1)
2CO + O2 \(\rightarrow\)2CO2 (2)
nCO2=\(\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Đặt nCH4=a
nCO=b
Ta có:
\(\left\{{}\begin{matrix}16a+28b=15\\a+b=0,75\end{matrix}\right.\)
a=0,5;b=0,25
mCH4=0,5.16=8(g)
% CH4 =\(\dfrac{8}{15}.100\%=53,3\%\)
% CO=100-53,3=46,7%
b;
Theo PTHH 1 và 2 ta có:
\(\sum n_{O_2}=0,5.2+0,25.\dfrac{1}{2}=1,125\left(mol\right)\)
VO2=1,125.22,4=25,2(lít)

a.4Al + 3O2 -> 2Al2O3
0.8 0.6 0.4
\(nO2=\dfrac{19.2}{32}=0.6mol\)
b.mAl = \(0.8\times27=21.6g\)
c.mAl2O3 = \(0.4\times102=40.8g\)

Bài 1:
\(n_{H_2SO_4}=0,1.0,5=0,05\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,05.98=4,9\left(g\right)\)
\(\Rightarrow n_H=2.n_{H_2SO_4}=2.0,05=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2O}=\frac{n_H}{2}=\frac{0,1}{2}=0,05\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,05.18=0,9\left(g\right)\)
Theo định luật bảo toàn khối lượng ta có:
\(m_{muoi}=m_{hhđ}+m_{H_2SO_4}-m_{H_2O}=2,81+4,9-0,9=6,81\left(g\right)\)
Bài 2/ Gọi CTHH của oxit M là M2Ox
\(M_2O_x\left(\frac{0,3}{x}\right)+2xHCl\left(0,6\right)\rightarrow2MCl_x+xH_2O\)
\(n_{HCl}=1.0,6=0,6\left(mol\right)\)
\(\Rightarrow m_{M_2O_x}=\frac{0,3}{x}.\left(2M+16x\right)=16\)
\(\Leftrightarrow M=\frac{56x}{3}\)
Thế x = 1, 2, 3, ... ta nhận x = 3, M = 56
Vậy công thức oxit đó là: Fe2O3

a) 4Al + 3O2 --to--> 2Al2O3
b) \(n_{O_2}=\dfrac{19,2}{32}=0,6\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,8<-0,6---------->0,4
=> mAl = 0,8.27 = 21,6(g)
c) mAl2O3 = 0,4.102 = 40,8(g)

a/ Ta có: \(n_{Mg}=\dfrac{4.8}{24}=0.2\left(mol\right)\)
PTHH:
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 1
0.2 x
\(=>x=\dfrac{0.2\cdot1}{2}=0.1=n_{O_2}\)
\(=>V_{O_2\left(đktc\right)}=0.1\cdot22.4=2.24\left(l\right)\)
b/ \(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 2
0.2 y
\(=>y=\left(0.2\cdot2\right):2=0.2=n_{MgO}\)
\(=>m_{MgO}=0.2\cdot\left(24+16\right)=8\left(g\right)\)

\(a) 4P+ 5O_2 \xrightarrow{t^o} 2P_2O_5\\ b) n_{O_2} = \dfrac{1,12}{22,4} = 0,05(mol)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,02(mol)\\ m_{P_2O_5} = 0,02.142 = 2,84(gam) c) 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{0,1}{3}(mol)\\ m_{KClO_3} = \dfrac{0,1}{3}122,5 = 4,083(gam)\)
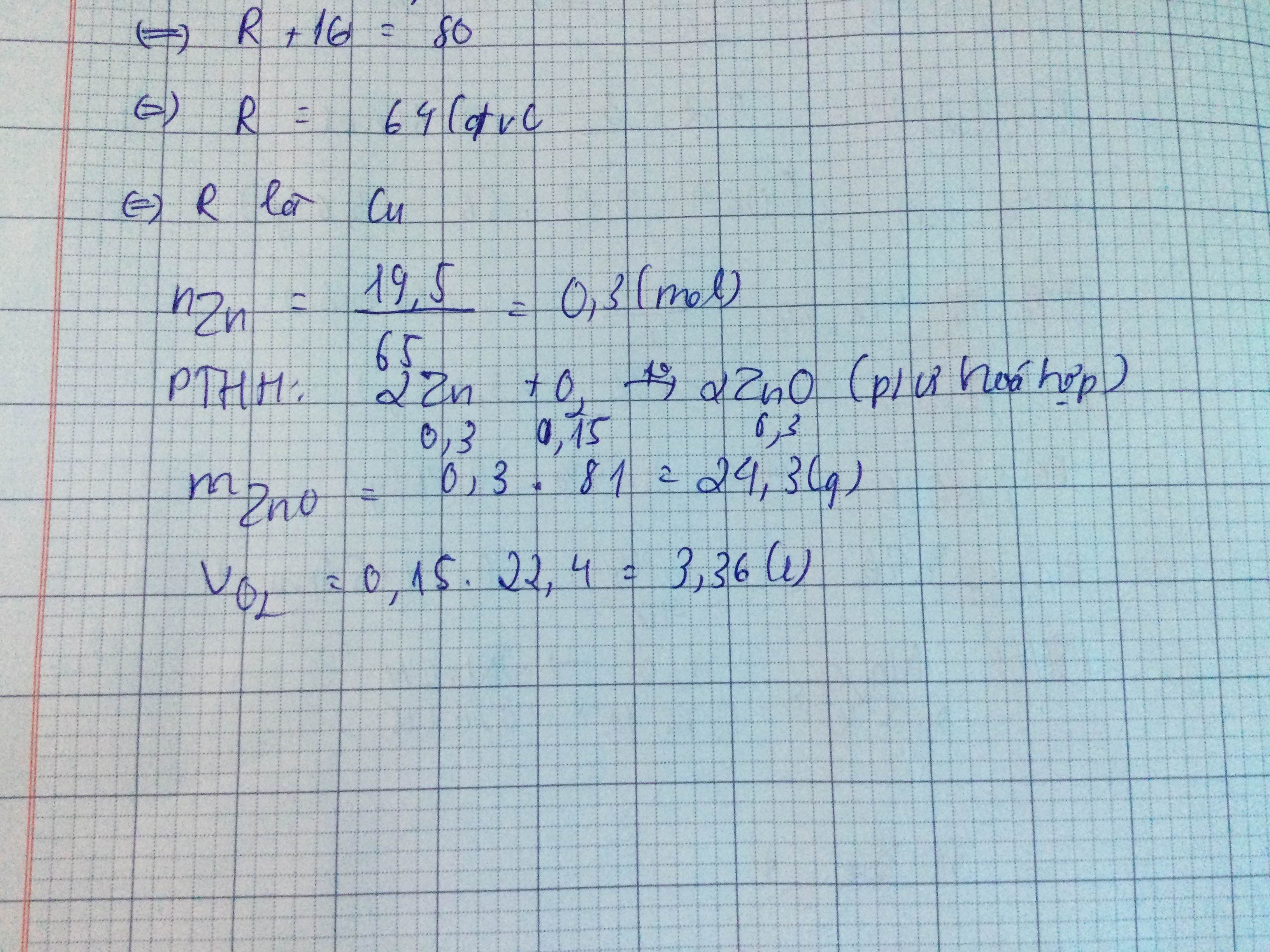
nZn=13:65=0,2(mol)
a)2Zn+O2\(\underrightarrow{to}\)2ZnO
....0,2....0,2....0,2...........(mol)
b)Theo PTHH:mZnO=0,2.81=16,2(g)
c)Theo PTHH:\(n_{O_2}\)=0,2(mol)
=>\(V_{O_2\left(đktc\right)}\)=0,2.22,4=4,48l
Theo đề bài ta có : nZn = \(\dfrac{13}{65}=0,2\left(mol\right)\)
a) PTHH :
2Zn + O2-t0\(\rightarrow\) 2ZnO
0,2mol..0,1mol...0,2mol
b) khối lượng ZnO thu được :
mZnO = 0,2.81 = 16,2 g
c) Thể tích O2 đã dùng là :
V\(O2_{\left(\text{đ}ktc\right)}=0,1.22,4=2,24\left(l\right)\)