Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nS =nSO2=0,2 mol
mS= 6,4 gam
độ tinh khiết = 6,4/6,8=94,12%

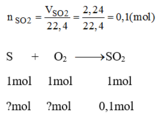
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol S O 2
Số mol của lưu huỳnh tham gia phản ứng:
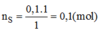
Khối lượng của lưu huỳnh tinh khiết: m S = n S . M S =0,1.32=3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
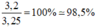

a) S + O2 \(\rightarrow\) SO2
b) Tính độ tinh khiết bằng cách lấy lượng lưu huỳnh tinh khiết(tức là lượng lưu huỳnh tham gia phản ứng ) chia cho lượng lưu huỳnh đề bài cho nhân với 100% . Mình giải luôn nhé!
nSO2 = V/22,4 = 2,24/22,4 =0,1(mol)
Theo PT => nS = nSO2 = 0,1(mol)
=> mS(tinh khiết) = n .M = 0,1 x 32 = 3,2(g)
=> độ tinh khiết của mẫu lưu huỳnh đã dùng = mS(tinh khiết) : mS(ĐB) x 100% = 3,2/3,25 x 100% =98,46%
c) Theo PT thấy nO2 = nSO2
mà số mol = nhau dẫn đến thể tích cũng bằng nhau
=> VO2 = VSO2 = 2,24(l)

Theo pt 1 mol O 2 phản ứng sinh ra 1 mol S O 2
Tỉ lệ thể tích cũng chính là tỉ lệ về số mol nên thể tích O 2 thu được 2,24 lít

\(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_C=n_{CO_2}=0,8\left(mol\right)\)
\(\Rightarrow m_C=0,8.12=9,6\left(g\right)\)
Độ tinh khiết của mẫu C là: \(\dfrac{9,6}{15}.100\%=64\%\)

PTHH: 3Fe + 2O2 → Fe3O4
Số mol của Fe3O4 là: 23,2 : 232 = 0,1 (mol)
Số mol của Fe là: 0,1 . 3 = 0,3 (mol)
Khối lượng Fe nguyên chất tham gia phản ứng là:
0,3 . 56 = 16,8 gam
% tinh khiết của mẩu sắt là: (16,8:21).100% = 80%
Ta có PT:
3Fe + 2O2 ---> Fe3O4
n\(Fe_3O_4\)=\(\frac{23,2}{232}\)=0,1(mol)
Theo PT ta có:
nFe tinh khiết = 3n\(Fe_3O_4\)= 3.0,1=0,3(mol)
mFe tinh khiết = 0,3.56 = 16,8(g)
Độ tinh khiết của sắt đã dùng
= \(\frac{16,8}{21}\).100%=80%

Đốt cháy 6,5 g lưu huỳnh không tinh khiết trong khí oxi dư,thu được 4,48 l khí SO2(đktc)
a,Viết PTHH của phản ứng
b,tính thể tích khí O2 dã phản ứng(đktc)
c,tính độ tinh khiết của mẫu lưu huỳnh trên
giải
a/\(S+O_2----->SO_2\)
b/nS=\(\dfrac{m}{M}=\)\(\dfrac{6,5}{32}=0,2\)mol
thep pthh ta có nS=nO2=0,2(mol)
Thể tích của khí oxi là :
VO2=n.22,4=0,2.22,4=4,48(lít)
Bạn tham khảo a;b thôi nhé c mik ko hỉu lắm
Biết rùi!!!!
c/nS=0,2(mol)
mS=0,2.32=6.4(gam)
VẬY ĐỘ TINH KHIẾT CỦA LƯU HUỲNH LÀ \(\dfrac{6,4}{6,5}.100\%=98,46\%\)
thế r ok bài

a) S + O2 → SO2
b) Tính độ tinh khiết bằng cách lấy lượng lưu huỳnh tinh khiết(tức là lượng lưu huỳnh tham gia phản ứng ) chia cho lượng lưu huỳnh đề bài cho nhân với 100% . Mình giải luôn nhé!
nSO2 = V/22,4 = 2,24/22,4 =0,1(mol)
Theo PT => nS = nSO2 = 0,1(mol)
=> mS(tinh khiết) = n .M = 0,1.32 = 3,2(g)
=> Độ tinh khiết của mẫu lưu huỳnh đã dùng = mS(tinh khiết) : mS(ĐB) x 100% = 3,2/3,25. 100% =98,46%
\(n_{SO_2}=\dfrac{4.48}{22,4}=0,2\left(mol\right)\)
PTHH : S + O2 ---to---> SO2
0,2 0,2
\(m_S=0,2.32=6,4\left(g\right)\)
Độ tinh khiết của lưu huỳnh là
\(\dfrac{6,4}{6,8}.100\%=94,11\%\)