Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chương II. PHẢN ỨNG HÓA HỌC
Bài 16. Phương trình hóa học

2H2 + O2 --to--> 2H2O
Xét \(\dfrac{0,2}{2}>\dfrac{0,08}{1}\) => H2 dư, O2 hết
=> Hiệu suất phản ứng tính theo O2
\(n_{O_2\left(pư\right)}=\dfrac{0,08.75}{100}=0,06\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
____0,12<-0,06------>0,12
=> \(Y\left\{{}\begin{matrix}m_{O_2}=\left(0,08-0,06\right).32=0,64\left(g\right)\\m_{H_2}=\left(0,2-0,12\right).2=0,16\left(g\right)\\m_{H_2O}=0,12.18=2,16\left(g\right)\end{matrix}\right.\)

a/ Ta có: \(n_{Mg}=\dfrac{4.8}{24}=0.2\left(mol\right)\)
PTHH:
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 1
0.2 x
\(=>x=\dfrac{0.2\cdot1}{2}=0.1=n_{O_2}\)
\(=>V_{O_2\left(đktc\right)}=0.1\cdot22.4=2.24\left(l\right)\)
b/ \(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 2
0.2 y
\(=>y=\left(0.2\cdot2\right):2=0.2=n_{MgO}\)
\(=>m_{MgO}=0.2\cdot\left(24+16\right)=8\left(g\right)\)

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\a, PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{O_2}=\dfrac{3}{4}.n_{Al}=\dfrac{3.0,2}{4}=0,15\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ c,2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\\ n_{KMnO_4}=2.n_{O_2}=2.0,15=0,3\left(mol\right)\\ \Rightarrow m_{KMnO_4}=158.0,3=47,4\left(g\right)\)

\(n_{N_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(N_2+O_2\underrightarrow{t^o}2NO\)
0,15 0,2 0
0,15 0,15 0,3
0 0,05 0,3
Sau phản ứng oxi còn dư và dư \(m=0,05\cdot32=1,6g\)
\(m_{NO}=0,3\cdot30=9g\)

\(n_{Na_2O}=\dfrac{124}{62}=2\left(mol\right)\)
PTHH: 4Na + O2 --to--> 2Na2O
1<----------2
=> mO2 = 1.32 = 32 (g)

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
\(m_{Al_2O_3}=0,1\cdot102=10,2g\)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,1 0,15
\(m_{KClO_3}=0,1\cdot122,5=12,25g\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(n_{Al}=5,4:27=0,2\left(mol\right)\)
\(\Rightarrow n_{Al_2O_3}=0,2.2:4=0,1\left(mol\right);n_{O_2}=0,2.3:4=0,15\left(mol\right)\)
\(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
b)\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(n_{O_2}=0,15\left(mol\right)\)(câu a)
\(\Rightarrow n_{KClO_3}=0,15.2:3=0,1\left(mol\right)\)
\(m_{KClO_3}=0,1.123,5=12,35\left(g\right)\)
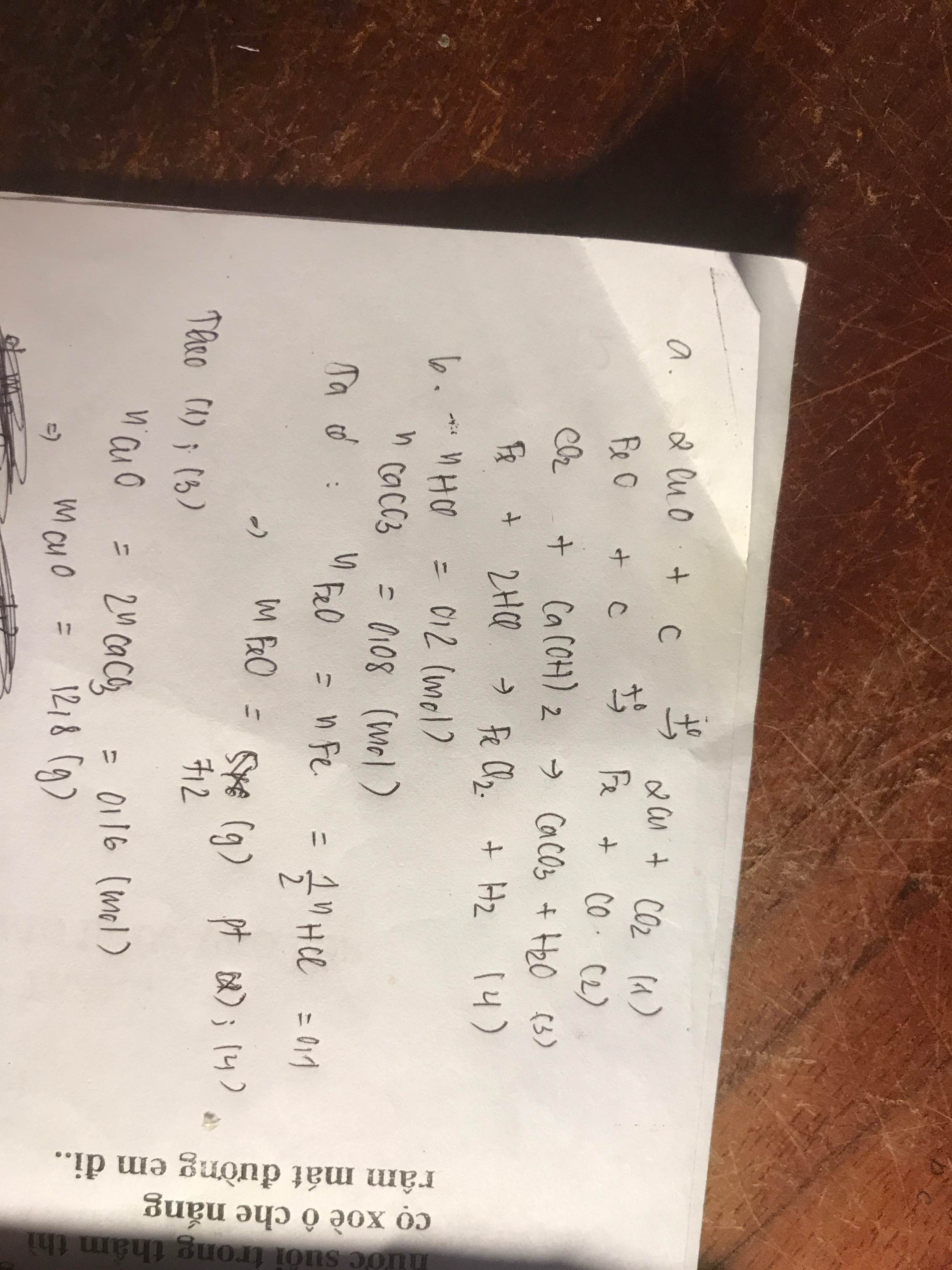

Phương trình phản ứng thứ nhất (1):
C2H2 + O2 \(\rightarrow\) CO2 + H2O
Tỉ số (1): 1:1:1:1:1
Phương trình phản ứng thứ hai (2):
CO2 + Ca(OH)2 \(\rightarrow\) CaCO3 + H2O
Tỉ số (2): 1:1:1:1
Cách 1:
Theo PTHH (1) ta có:
\(n_{C_2H_2}\) = \(n_{O_2}\) = \(n_{CO_2}\) = \(n_{H_2O}\) = \(\dfrac{26}{12.2+1.2}\) = 1 (mol)
\(\Rightarrow\)\(m_{O_2}\)=1.32=32 (gam)
Mình định dùng cả cách 2 nhưng phải vận dụng cả kiến thúc phần sau nên mình chỉ dùng cách 1 thôi.