Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(PTHH:2Mg+O_2\rightarrow^{t^o}2MgO\)
x 0,5x
\(4Al+3O_2\rightarrow^{t^o}2Al_2O_3\)
y 0,75y
Gọi số mol của Mg là x ; Số mol của Al là y(\(x;y>0\))
\(\Rightarrow m_{Mg}=24x;m_{Al}=27y\)
\(\Rightarrow24x+27y=10,35\)(1)
\(n_{O_2}=5,88:22,4=\frac{21}{80}\left(mol\right)\)
\(\Rightarrow0,5x+0,75y=\frac{21}{80}\)(2)
Từ (1) và (2) ta có hệ phương trình:
\(\hept{\begin{cases}24x+27y=10,35\\0,5x+0,75y=\frac{21}{80}\end{cases}}\)\(\Rightarrow\hept{\begin{cases}x=0,15\\y=0,25\end{cases}}\)
\(m_{Mg}=24.0,15=3,6\left(g\right)\)
\(m_{Al}=27.0,25=6,75\left(g\right)\)
\(\%m_{Mg}=\frac{3,6}{10,35}.100\approx35\%\)
\(\%m_{Al}=100\%-35\%=65\%\)

Gọi $n_{Mg} = a(mol) ; n_{Al} = b(mol) \Rightarrow 24a + 27b = 10,35(1)$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$n_{O_2} = \dfrac{1}{2}a + \dfrac{3}{4}b = \dfrac{5,88}{22,4} = 0,2625(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,25
$m_{Mg} = 0,15.24 = 3,6(gam)$
$m_{Al} = 0,25.27 = 6,75(gam)$

a)
Theo ĐLBTKL: \(m_{Fe\left(bđ\right)}+m_{O_2}=m_X\)
=> \(m_{O_2}=26,4-20=6,4\left(g\right)\)
=> \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\Rightarrow V=0,2.22,4=4,48\left(l\right)\)
b)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,2------->0,1
=> \(\%m_{Fe_3O_4}=\dfrac{0,1.232}{26,4}.100\%=87,88\%\)
c)
- Nếu dùng KClO3
PTHH: 2KClO3 --to--> 2KCl + 3O2
\(\dfrac{0,4}{3}\)<-----------------0,2
=> \(m_{KClO_3}=\dfrac{0,4}{3}.122,5=\dfrac{49}{3}\left(g\right)\)
- Nếu dùng KMnO4:
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,4<--------------------------------0,2
=> \(m_{KMnO_4}=0,4.158=63,2\left(g\right)\)

a, \(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
b, \(\dfrac{m_{CuO}}{m_{MgO}}=\dfrac{2}{1}\Rightarrow\dfrac{n_{CuO}}{n_{MgO}}=\dfrac{2}{1}:\dfrac{80}{40}=1\)
⇒ nCuO = nMgO (1)
Có: m chất rắn tăng = mO2 = 32 (g)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{CuO}+\dfrac{1}{2}n_{MgO}=\dfrac{32}{32}=1\left(mol\right)\left(2\right)\)
Từ (1) và (2) ⇒ nCuO = nMgO = 1 (mol)
⇒ mCuO = 1.80 = 80 (g)
mMgO = 1.40 = 40 (g)

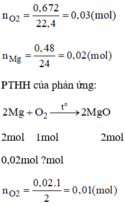
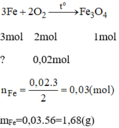
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$n_{O_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
$n_{Mg} = 2n_{O_2} = 0,06.2 = 0,12(mol)$
$m_{Mg} = 0,12.24 = 2,88(gam)$
$\Rightarrow m_{Al_2O_3} = 13,08 - 2,88 = 10,2(gam)$