Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Số mol photpho : 0,4 (mol).
Số mol oxi : 0,53 (mol).
Phương trình phản ứng :
4P + 5O2 -> 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
b) Chất được tạo thành là P2O5 . Theo phương trình phản ứng, ta có :
0,2 (mol).
Khối lượng điphotpho pentaoxit tạo thành là : m = 0,2.(31.2 + 16.5) = 28,4 gam.
a) PTHH: 4P + 5O2 -to-> 2P2O5
Ta có: \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{0,4}{4}< \dfrac{\dfrac{17}{32}}{5}\)
=> P hết, O2 dư nên tính theo nP.
=> \(n_{O_2\left(phảnứng\right)}=\dfrac{5.0,4}{4}=0,5\left(mol\right)\\ =>n_{O_2\left(dư\right)}=\dfrac{17}{32}-0,5=\dfrac{1}{32}\left(mol\right)\)
b) Chất tạo thành sau phản ứng là P2O5 (điphotpho pentaoxit).
Theo PTHH và đề bài, ta có:
\(n_{P_2O_5}=\dfrac{2.0,4}{4}=0,2\left(mol\right)\)
Khối lượng P2O5 tạo thành sau phản ứng:
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)

a)
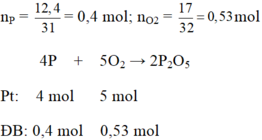
Xét tỉ lệ số mol đề bài với số mol phương trình của P và O2 ta có:

b) Chất tạo thành: đi photpho pentaoxit P2O5
Theo phương trình 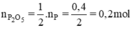
mP2O5 = n.M = 0,2.(31.2 + 16.5) = 28,4 (g)

Bài 4:
a) \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\) => P hết, O2 dư
PTHH: 4P + 5O2 --to--> 2P2O5
0,4-->0,5--------->0,2
=> \(n_{O_2\left(dư\right)}=0,53125-0,5=0,03125\left(mol\right)\)
b) \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)

\(n_P=\dfrac{m_P}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,4 < 0,53125 ( mol )
0,4 0,5 0,2 ( mol )
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là P2O5
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,2.142=18,4g\)

nP = 24.8 / 31 = 0.8 (mol)
nO2 = 34 / 32 = 1.0625 (mol)
4P + 5O2 -to-> 2P2O5
Bđ: 0.8.....1.0625
Pư: 0.8.........1...............0.4
KT : 0..........0.0625.........0.4
mO2 (dư) = 0.0625 * 32 = 2 (g)
mP2O5 = 0.4 * 142 = 56.8 (g)
PTHH: 4P + 5O2 -\(t^0\) --> 2P2O5
ta có n=m/M
=> nP =0,8 và nO2=2,125
theo pt có
nP/4=0,2 < nO2/5=0,425
=> Oxi dư
theo pt
\(\dfrac{nO2\left(pư\right)}{nP}=\dfrac{5}{4}\Rightarrow nO2\left(pư\right)=\dfrac{5}{4}\cdot0,8=1mol\)
nO2(dư)= 2,125-1=1,125mol
b, chất đc tạo thành là: đi photpho penta oxit
theo pt
\(\dfrac{nP2O5}{nP}=\dfrac{2}{4}\Rightarrow nP2O5=\dfrac{2}{4}\cdot0,8=0,4mol\)
ADCT: m=nM
=> mP2O5=0,4*142=56,8g

\(n_P=\dfrac{m_p}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 5 2 ( mol )
0,4 0,53125 ( mol )
ta có: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\)
=> Chất dư là \(O_2\)
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là \(P_2O_5\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=\left(\dfrac{0,4.2}{4}\right).142=28,4g\)

Số mol photpho và khí oxi lần lượt là 12,4:31=0,4 (mol) và 17:32=0,53125 (mol).
A) 4P (0,4 mol) + 5O2 (0,5 mol) \(\underrightarrow{t^o}\) 2P2O5 (0,2 mol).
0,4:4<0,53125:5 nên khí oxi dư và dư 0,53125-0,5=0,03125 (mol).
B) Điphotpho pentaoxit (P2O5) được tạo thành có khối lượng là 0,2.142=28,4 (g).

a) Số mol photpho và khí oxi lần lượt là 12,4:31=0,4 (mol) và 19,2:32=0,6 (mol).
4P (0,4 mol) + 5O2 (0,5 mol) \(\underrightarrow{t^o}\) 2P2O5 (0,2 mol).
Do 0,4:4<0,6:5 nên khí oxi dư 0,6-0,5=0,1 (mol).
b) Điphotpho pentaoxit (P2O5) được tạo thành có khối lượng 0,2.142=28,4 (g).

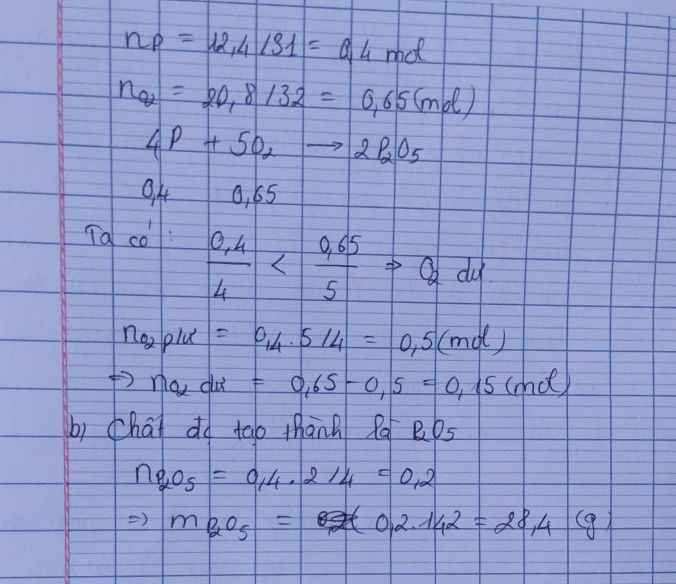
a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{17}{32} = 0,53125(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,5(mol)$
$\Rightarrow n_{O_2\ dư} = 0,53125 - 0,5 = 0,03125(mol)$
b) Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$
tks