Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3Fe+2O2= Fe3O4 (1)
2Mg+O2= 2MgO (2)
nMg= 0,48:24= 0,02 mol
theo (2), nO2= 1/2 nMg= 0,01 mol
mà tổng số mol cần dùng là 0,672:22,4= 0,03 mol
=> nO2 ở (1) = 0,02 mol
theo (1), nFe= 3/2 nO2= 0,03 mol
=> mFe= 0,03. 56= 1,68 g

Gọi x, y lần lượt là số mol của Fe và Mg.
Theo đề, ta có: \(56x+24y=13,2\) (*)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\left(1\right)\)
\(2Mg+O_2\overset{t^o}{--->}2MgO\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}56x+24y=13,2\\\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)

1. a. \(PTHH:2Mg+O_2\overset{t^o}{--->}2MgO\left(1\right)\)
b. Ta có: \(n_{Mg}=\dfrac{24}{24}=1\left(mol\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}.0,1=0,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,5.22,4=11,2\left(lít\right)\)
c. \(PTHH:2KClO_3\xrightarrow[t^o]{MnO_2}2KCl+3O_2\left(2\right)\)
Theo PT(2): \(n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,5=\dfrac{1}{3}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{1}{3}.122,5=40,83\left(g\right)\)
2. \(PTHH:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
a. Theo PT: \(n_{Fe}=3.n_{Fe_3O_4}=0,01.3=0,03\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
b. Theo PT: \(n_{O_2}=2.n_{Fe_3O_4}=2.0,01=0,02\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,02.22,4=0,448\left(lít\right)\)
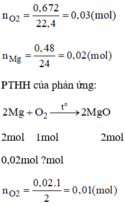
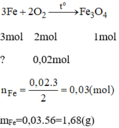

\(n_{Mg}=\dfrac{0.48}{24}=0.02\left(mol\right)\)
\(n_{O_2}=\dfrac{0.672}{22.4}=0.03\left(mol\right)\)
\(2Mg+O_2\underrightarrow{t^0}2MgO\)
\(0.02...0.01\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.03...\left(0.03-0.01\right)\)
\(m_{Fe}=0.03\cdot56=1.68\left(g\right)\)
\(m_{hh}=1.68+0.48=2.16\left(g\right)\)