Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

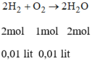
* Chú ý: cùng đktc: tỉ lệ số mol = tỉ lệ thể tích
Tỉ số mol của H 2 và O 2 :
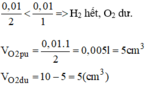
Chọn D

Đổi: 10 cm3 = 0,01 dm3 = 0,01 lít
100 cm3 = 0,1 dm3 = 0,1 lít kk
VO2 = \(\dfrac{1}{5}\)Vkk = \(\dfrac{0,1}{5}=0,02\) (lit)
Pt: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ mol giữa CH4 và O2:
\(\dfrac{0,01}{1}=\dfrac{0,02}{2}\)
Vậy pứ hết
P/s: tỉ lệ về thể tích cũng là tỉ lệ về số mol đối với chất khí

- Có 1 cặp toàn đơn chất: Nhóm a
- Có 1 cặp toàn hợp chất: Nhóm f
- Có 4 cặp gồm 1 đơn chất và 1 hợp chất:
+ Nhóm b có đơn chất Nitơ N2 và hợp chất là khí Cacbonic CO2.
+ Nhóm c có đơn chất Oxi O2 và hợp chất là khí Cacbonic CO2.
+ Nhóm d có đơn chất Oxi O2 và hợp chất là hơi nước H2O(hơi).
+ Nhóm e có đơn chất Nitơ N2 và hợp chất là hơi nước H2O(hơi).

Chọn: D.
Đó là: Khí nitơ và khí cacbon đioxit; Khí oxi và khí cacbon đioxit; Khí oxi và hơi nước;
Khí nitơ và hơi nước.

Ta có nH=5:22,4=\(\frac{25}{112}\) mol
pthh:4H+O2\(\rightarrow\)2H2O
\(\Rightarrow\)nO2= \(\frac{1}{4}.\frac{25}{112}=\frac{25}{448}\) MOL
VO2=\(\frac{25}{448}.22,4=1,25\) lít
vì VO2=\(\frac{1}{5}\)Vkk\(\Rightarrow\) 1,25.5=6,25(lít)
vậy Vkk=6,25 lít
chúc bạn học tốt like mình nha![]()

Để xác định công thức phân tử của hợp chất (X), ta cần phân tích tỷ lệ thể tích các chất tham gia và sản phẩm của phản ứng cháy.
Theo thông tin trong đề bài, để đốt cháy hết 0,2 ml hơi của hợp chất (X), cần 0,06 ml khí oxi. Sản phẩm của phản ứng cháy là 0,4 ml CO2 và 0,06 ml hơi nước.
Ta biết rằng phản ứng cháy của hợp chất (X) có thể được biểu diễn bằng phương trình:
CₓHₓ + yO₂ → zCO₂ + wH₂O
Từ đó, ta có thể lập các phương trình cân bằng thể tích:
0,2 ml hơi (X) → 0,4 ml CO₂ 0,06 ml O₂ → 0,4 ml CO₂
Vì tỷ lệ giữa hơi (X) và O₂ là 1:0,3 (0,2 ml / 0,06 ml), và tỷ lệ giữa CO₂ và O₂ là 0,4:0,06 (0,4 ml / 0,06 ml), nên ta có thể suy ra tỷ lệ giữa hợp chất (X) và CO₂ là 1:0,75 (1:0,3 * 0,4:0,06).
Nếu ta giả sử số mol của hợp chất (X) là a, số mol của CO₂ là b, ta có thể viết lại tỷ lệ trên dưới dạng số mol:
a : 1 b : 0,75
Vì CO₂ có 1 mol cacbon (C) và 2 mol oxi (O₂) trong phân tử, nên số mol cacbon (C) trong hợp chất (X) cũng là b.
Vậy, công thức phân tử của hợp chất (X) là CbHb.
Đốt 10cm3 khí hiđro trong 10cm3 khí oxi. Thể tích chất khí hoặc chất hơi còn lại sau phản ứng ở 100oCoC và áp suất của khí quyển là:
a, 5cm3 hiđro và 10cm3 hơi nước
b, 10cm3 hidro và 10 cm3 hơi nước
c, Chỉ có 10cm3 hơi nước
d, 5cm3 oxi và 10cm3 hơi nước
e, 10cm3 oxi và 10cm3 hơi nước
nói chung ta theo phản ứng
2H2+O2-->2H2O
D