Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi cho 0,1 mol X gồm vào dung dịch Ba(OH)2 thì:
n C O 2 = 0 , 02 m o l ⇒ nkhí còn lại = 0,08 mol
Hỗn hợp khí X gồm CO2 (x mol); CO (y mol) và CO2 (z mol). Ta có:
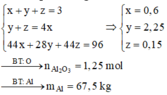

Đáp án C
Giải:
CaCO3=0.2
d O2/H2=16 nên theo tích chéo ta có nCO/nCO2=3
vậy 33,6 khối khí có 20%CO2 và 60%CO và 20%O2 hay 2.1 nhkn 10 ngũ 3 mol Oxi nguyên tử m=37,8 kg

Đáp án : B
Z có : nCO = nCO2 = 0,03 mol
=> nO pứ = nCO pứ = 0,03 mol. Đặt nO dư = a
=> Coi Y gồm Kim loại và O dư a mol
=> m = (100/25).16(a + 0,03) = 64(a + 0,03)
=> nNO3 muối = 2a + 0,04.3 = 2a + 0,12 mol
=> 3,08.64(a + 0,03) = [64(a + 0,03) – 16(a + 0,03)] + 62(2a + 0,12)
=> a = 0,118 => m = 64( 0,118 + 0,03) = 9,472g

Đáp án : A
Hỗn hợp Z gồm CO và CO2 có M = 36 dùng đường chéo => tỷ lệ mol CO = CO2 = 0,03 mol
Số mol O phản ứng = CO = 0,03 mol nên số mol O còn trong Y = (0,25m/16 - 0,03)
Khối lượng kim loại trong Y : 0,75m.
Khi phản ứng với HNO3 tạo muối có 2 loại: NO3- tạo muối thay thế O2- là 2(0,25m/16 - 0,03)(không tạo sp khử) và NO3- tạo muối có sp khử:
Số mol NO3- tạo muối tính theo NO = 0,04.3 = 0,12 mol
áp dụng BTKL: 3,08m = 0,75m + 62.0,12 + 62.2(0,25m/16 - 0,03)
=> m = 9,477 gần giá trị 9,5.
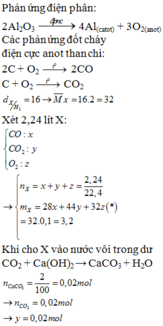



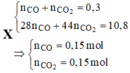
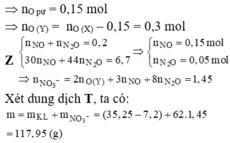
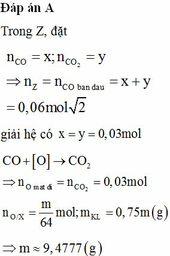
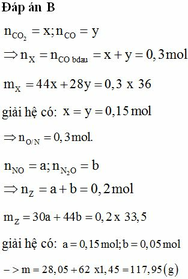
Đáp án C