

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
• Xét tại thời điểm th; dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1:1 nên.
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e → Cu0; ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Dung dịch X Phản ứng với Al sinh ra a mol H2 → lượng H+ đã phản ứng = 2a mol.
||→ Số mol e trao đổi = b + 2a mol .
• Xét tại thời điểm 2th, số mol e trao đổi = 2 (2a + b) mol.
Ở catot: Cu2+ + 2e → Cu0 ; 2H2O + 2e → 2OH- + H2 || Ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Số mol e Cl- nhường = b mol → số mol e H2O nhường = 4a + b mol → Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol → Số mol e H2O nhận = 4a mol → số mol OH- = 4a mol.
Trong dung dịch có OH- và H+ nên : H+ + OH- → H2O.
||→ Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ → Al3+ + 3/2 H2.
||→ Số mol H2 = b /2 = 4a → a : b = 1 : 8
• Xét các nhận định:
+ Tại thời điểm 2th số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25 (4a + b ) , thay b = 8 a → số mol khí thoát ra = 9a mol → (1) đúng.
+ Tại thời điểm 1,75t h thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,75 (2a + b)
||→ 0,25b < 3,5a → a : b < 1 / 3 đúng (do a : b = 0,75). → (2) đúng.
+ Tại thời điểm 1,5t h thì số mol e trao đổi = 1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
||→ 0,5b < 3a → a : b < 1 / 6 → đúng (do a : b = 1:8 ). → (3) đúng.
+ Tại thời điểm 0,8t h thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- điện phân hết → số mol e Cl- nhường= b mol < 0,8 (2a + b)
||→ 0,2b < 1,6 a → a : b < 1 / 8 đúng (do a : b = 1:8). → (4) đúng.
+ Tại thời điểm 2th thì số mol H2 sinh ra = 2a mol. → (5) sai.

|
6.8 |
6.9 |
6.10 |
|
A |
D |
A |
6.8. Chọn A
Gọi công thức của 2 kim loại là
Ta có:
2¯¯¯¯¯¯M+2H2O→2MOH+H2⇒n¯¯¯¯¯¯M=2.nH2=0,05(mol)⇒¯¯¯¯¯¯M=1,360,05=27,1(g/mol)

1. - dùng quỳ tím: hóa đỏ khi tiếp xúc với H2SO4. ko đổi màu khi tiếp xúc với NaCl.
- dùng dd BaCl2: tạo kết tủa BaSO4 với H2SO4. ko pư với NaCl.
- dùng dd AgNO3: tạo kết tủa AgCl với NaCl. ko pư với H2SO4.
- dùng Fe: tạo khí khi cho vào H2SO4. ko pư với NaCl

Câu 1 : Kim loại trong dãy có nhiệt độ nóng chảy cao nhất là
A. W. B. Fe. C. Al. D. Na.
Câu 2: . Có các loại kim loại: Zn, Ni, Sn, Cu. Kim loại có thể dùng để bảo vệ điện hoá vỏ tàu biển làm bằng thép là
A. Sn. B. Ni. C. Zn. D. Cu.
Câu 3: Kim loại có thể điều chế bằng phương pháp điện phân dung dịch muối halogenua là
A. Na. B. Cu. C. Ca. D. K.
Câu 4: Ngâm một đinh sắt sạch trong dung dịch HCl thì sắt bị ăn mòn chậm. Nếu thêm vài giọt CuSO4 thì sắt ăn mòn nhanh hơn. Thí nghiệm trên chứng tỏ
A. Fe bị ăn mòn hoá học, sau đó bị ăn mòn điện hoá học.
B. Đây là hiện tượng ăn mòn điện hoá học.
C. Đây là hiện tượng ăn mòn hoá học.
D. Fe bị ăn mòn điện hoá, sau đó bị ăn mòn hoá học.
Câu 5: Thuỷ ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thuỷ ngân bị vỡ thì dùng chất nào trong các chất sau đây để khử độc thuỷ ngân?
A. Bột lưu huỳnh. B. Bột Fe. C. Bột than. D. Nước.
Câu 6: Cho 9,75 gam một kim loại M tác dụng hết với nước thu được 2,8 lít khí (đktc). Kim loại M là
A. Li. B. Ca. C. Na. D. K.
Câu 7. Điện phân(điện cực trơ) dung dịch muối đồng (II) clorua với dòng điện cường độ 3A. Sau 1930 giây thì dừng quá trình điện phân. Khối lượng kim loại thoát ra ở catot là
A. 1,92 g. B. 1,29 g. C. 19,2g. D. 12,9g.
Câu 8. Chất nào sau đây được dùng bó bột khi xương bị gãy?
A. Vôi tôi. B. Đá vôi. C. Tinh bột. D. Thạch cao.
Câu 9: Hiện tượng nào xảy ra khi cho kim loại K vào dung dịch CuSO4?
A. Có kết tủa màu đỏ, dung dịch nhạt dần.
B. Sủi bọt khí không màu và có kết tủa màu đỏ.
C. Có kết tủa màu đỏ.
D. Sủi bọt khí không màu và có kết tủa màu xanh.
Câu 10: Kim loại không tác dụng với nước ở nhiệt độ thường là
A. Na. B. Ca. C. Sr. D. Mg.
Câu 11: Nhỏ từ từ dung dịch NaOH vào dung dịch X thấy dung dịch vẩn đục. Nhỏ tiếp dung dịch NaOH vào thấy dung dịch trong trở lại. X là dung dịch nào sau đây?
A. Al2(SO4)3. B. Fe2(SO4)3. C. NaAlO2. D. (NH4)2SO4.
Câu 12: Chỉ dùng một hoá chất để phân biệt 3 chất rắn Mg, Al2O3, Al . Hoá chất đó là
A. H2SO4. B. NaOH. C. Al(OH)3 D. HCl.
Câu 13: Cho m gam kim loại Al tác dụng với một lượng dư dung dịch NaOH, thu được 3,36 lít khí H2 (ở đktc). Giá trị của m là: ( Cho Al = 27, H = 1)
A. 8,1g. B. 2,7g. C. 5,4g. D. 10,8g.
Câu 14: Sục a mol khí CO2 vào dung dich Ca(OH)2 dư thu được 3 gam kết tủa. Giá trị của a là
A. 0,03 mol. B. 0,04 mol. C. 0,05 mol. D. 0,06 mol.
Câu 15: Chất nào sau đây là chất khử oxit sắt trong lò cao?
A. H2. B. CO. C. Al. D. Na.
Câu 16: Kim loại không phản ứng được với H2SO4 đặc nguội là
A. Cu. B. Ag. C. Fe. D. Mg.
Câu 17: Cho kim loại Fe vào dung dịch Fe3+ có màu vàng. Hiện tượng gì sẽ xảy ra.
A. Dung dịch chuyển từ màu vàng sang màu lục nhạt.
B. Dung dịch chuyển từ màu vàng sang màu đỏ nâu.
C. Dung dịch chuyển từ màu vàng sang màu xanh lam.
D. Dung dịch giữ nguyên màu vàng.
Câu 18: Để phân biệt 2 mẫu hợp kim: Al-Fe và Fe-Cu. Người ta có thể dùng hóa chất nào sau đây:
A. Nước. B. dung dịch muối ăn. C. dung dịch HCl. D. Quỳ tím.

Đáp án B
- Đặt số mol của Cu(NO3)3 và NaCl là x và y
- Phương trình điện phân:
Tại catot:
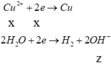
Tại anot
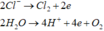
- Điện phân t(s):
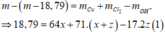
- Điện phân 2t(s): hỗn hợp khí T chứa 3 khí
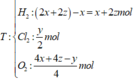
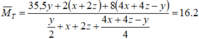
![]()
a gam dung dịch Z:
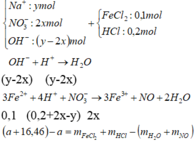
Dung dịch sau phản ứng không chứa H+
=> H + phản ứng hết
16 , 46 = 127 , 01 + 36 , 5 . 0 , 2 - 18 . y - 2 x + 0 , 2 + 2 x - y 2 - 30 . 0 , 2 - 2 x - y 4 ( 3 )
Từ (1), (2), (3) suy ra:
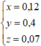
=> m=188x + 58,5y = 45,96 g
a = 62.2x + 23y + 17.(y-2x) = 26,8 => a + m = 72,76 g