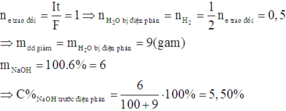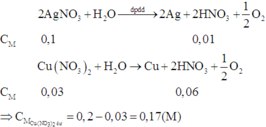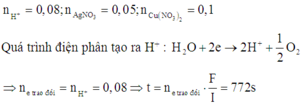Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Quá trình điện phân dung dịch NaOH chỉ xảy ra quá trình điện phân H2O làm tăng nồng độ của NaOH:
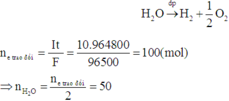
Dung dịch sau phản ứng có:
![]()
Do đó, trước điện phân, dung dịch có:
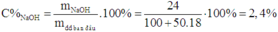

Đáp án C
Có các quá trình diễn ra tại các điện cực khi điện phân:

Khi cho X vào dung dịch NaOH ở nhiệt độ thường:
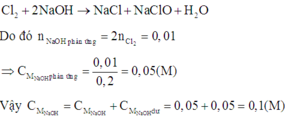

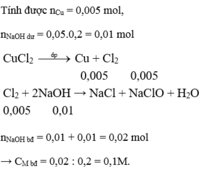
Giải thích: Đáp án C
+ Bình 1: nNaOH=0,0346 mol
Sau khi x mol H2O bị điện phân thì thể tích dung dịch còn lại là 20-18x (ml)
=> CM=0,0346/[(20-18x)/1000] = 2
=> x=0,15
=> ne = 2x = 0,3
Bình 2:
Tại catot:
Cu2+ +2e → Cu
0,15.....0,3
Cu2+ dư 0,225-0,15=0,075 mol
Tại anot:
Cl- -1e → 0,5 Cl2
0,2→0,2
H2O – 2e → 0,5O2 + 2H+
0,1 → 0,1
Dung dịch trong bình 2 sau điện phân gồm: 0,075 mol Cu2+; H+: 0,2+0,1=0,3 mol
Khi cho 0,25 mol Fe vào:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Bđ: 0,25 0,3 0,45
Pư: 0,1125← 0,3 →0,075
Sau: 0,1375
Fe + Cu2+ → Fe2+ + Cu
Bđ:0,1375 0,075
Pư:0,075 ← 0,075 →0,075
Sau:0,0625 0,075
=> m chất rắn = 0,0625.56+0,075.64=8,3 gam

Đáp án C

- Sau điện phân:
+ Thể tích dung dịch NaOH ở bình 1 = 0 , 0692 2 =0,03461=34,6 ml
=> Thể tích nước bị điện phân = 40 - 34,6 = 5,4 ml
=> Số mol nước bị điện phân ở bình 1 = 5 , 4 18 = 0,3 mol
+ Bình 2:
n Cu = n H 2 O điện phân ( I ) = 0 , 3 mol ⇒ n Cu 2 + dư = 0 , 45 - 0 , 3 = 0 , 15 mol n Cl 2 = 1 2 n Cl - = 0 , 2 mol ⇒ n H 2 O điện phân ( 1 ) = 0 , 3 - 0 , 2 = 0 , 1 mol ⇒ n H + = 0 , 2 + 0 , 4 = 0 , 6 mol
- Cho 0,5 mol Fe vào dung dịch bình 2 sau phản ứng điện phân
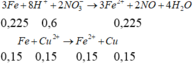
=> m = 56.(0,5-0,225-0,15)+64.0,15=16,6 gam gần với giá trị 17 nhất