Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A.
Đặt số mol của CuSO4 và KCl lần lượt là x, y.
Phương trình điện phân:
Catot: Cu2+ +2e → Cu
2H2O + 2e → 2OH- + H2
Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + 4e + O2
Điện phân t giây:
0 , 5 y + n O 2 t = 2 , 688 22 , 4 = 0 , 12 m o l
⇒ n O 2 t = 0 , 12 - 0 , 5 y
=> nđiện phân = y + 4 . 0 , 12 - 0 , 5 y = 0 , 48 - y
Điện phân 2t giây:
nđiện phân = 2 . 0 , 48 - y mol
⇒ n O 2 2 t = 0 , 24 - 0 , 75 y mol
mcatot tăng = 64 x = 18 , 56 ⇒ x = 0 , 29
⇒ n H 2 = 019 - y
⇒ m = 160 x + 74 , 5 y = 55 , 34 g

Chọn đáp án A
Xét t(s): Khối lượng catot tăng ⇒ ion M2+ bị điện phân. Khí duy nhất ở anot là Cl2.
2Cl– → Cl2 + 2e ⇒ ne = nNaCl = 2nCl2 = 0,4 mol ⇒ mMSO4 = 43,24 - 0,4 × 58,5 = 19,84(g).
Xét 2t(s): ne = 0,8 mol || 2H2O → 4H+ + O2 + 4e ⇒ nO2 = 0,1 mol.
⇒ manot giảm = 0,2 × 71 + 0,1 × 32 = 17,4(g) ⇒ mcatot giảm = 8,096(g).
Đặt nMSO4 = x ⇒ (M + 96).x = 19,84 (1) || 2H2O + 2e → 2OH– + H2
⇒ nH2 = (0,8 – 2x) ÷ 2 = 0,4 – x ⇒ 2 × (0,4 – x) + M.x = 8,096 (2)
(1) và (2) ⇒ M.x = 7,552 và x = 0,128 ⇒ M = 7,552 ÷ 0,128 = 59 (Ni).

Chọn C
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+ chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu
0,36 ←0,18
2H2O + 2e → 2OH- + H2.
Anot: 2Cl- → Cl2 + 2e
2x x 2x
2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

Chọn đáp án C.
Phương trình điện phân:
Catot: C u 2 + + 2 e → C u
![]()
![]()
· Điện phân t giây:
m C u = m c a t o t = 5 , 12 g
⇒ n C u 2 + p h ả n ứ n g = 0 , 08 m o l
· Điện phân 3t giây:
m C u = 11 , 52 g ⇒ n C u 2 + = 0 , 18 m o l
⇒ n H 2 = 2 . 3 . 0 , 08 - 2 . 0 , 18 2 = 0 , 06 m o l
⇒ n C l 2 + n O 2 = 6 , 272 22 , 4 - 0 , 06 = 0 , 22 m o l 2 n C l 2 + 4 n O 2 = 6 . 0 , 08 = 0 , 48 m o l
⇒ n C l 2 = 0 , 2 m o l n O 2 = 0 , 02 m o l
![]()

Đáp án A
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e
0,36 ←0,18 2x x 2x
2H2O + 2e → 2OH- + H2. 2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)








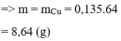
Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b
=> a+b=0,12
Bảo toàn e: n e = 2 a + 4 b
Lúc 2t giây: n e = 4 a + 8 b
Lúc này ở anot thu được Cl2 a mol và O2 → n O 2 = 4 a + 8 b - 2 a 4 = 0 , 5 a + 2 b
Do vậy ở catot thu được là H2 với số mol H2 = 0 , 5 a + 2 b + a 3 = 0 , 5 a + 2 b 3
Bảo toàn e:
n C u 2 + = 2 a + 4 ( 0 , 5 a + 2 b ) - 2 ( 0 , 5 a + 2 b 3 ) 2 = 1 , 5 a + 10 b 3 → 64 ( 1 , 5 a + 10 b 3 ) = 18 , 56
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.