Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có : λo = 2300Ǻ = 2,3.10-7 (m). h= 6,625.10-34 (J.s), c = 3.108 m/s.
Emax=1,5( eV) = 1,5.1,6.10-19= 2,4.10-19(J)
Mặt khác: Theo định luật bảo toàn năng lượng và hiện tượng quang điện ta có công thức
(h.c)/ λ = (h.c)/ λo + Emax suy ra: λ=((h.c)/( (h.c)/ λo + Emax)) (1)
trong đó: λo : giới hạn quang điện của kim loại
λ: bước sóng của ánh sáng chiếu vào bề mặt kim loại để bứt electron ra khỏi bề mặt kimloại.
Emax: động năng ban đầu ( năng lượng của ánh sáng chiếu vào bề mặt kim loại).
Thay số vào (1) ta có:
λ = ((6,625.10-34.3.108)/((6,625.10-34.3.108)/(2,3.10-7) + (2,4.10-19)) = 1,8.10-7(m)
= 1800 Ǻ
Thầy xem hộ em lời giải của bài này ạ, em trình bày chưa được rõ ràng mong thầy sửa lỗi cho em ạ. em cám ơn thầy ạ!
Năng lượng cần thiết để làm bật e ra khỏi kim loại Vonfram là:
E===5,4eV
Để electron bật ra khỏi kim loại thì ánh sáng chiếu vào phải có bước sóng ngắn hơn bước sóngtấm kim loại. Mà năng lượng ánh chiếu vào kim loại có E1<E nên electron không thể bật ra ngoài

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 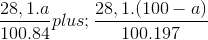 = 0,2
= 0,2
=> a = 29,89.

Áp dụng ĐLBTKL:
mhh = mX + mY + mCO3 = 10 g; mA = mX + mY + mCl = 10 - mCO3 + mCl.
số mol CO3 = số mol CO2 = 0,03 mol.
Số mol Cl = 2 (số mol Cl2 = số mol CO3) (vì muối X2CO3 tạo ra XCl2, Y2CO3 tạo ra 2YCl3).
Do đó: mA = 10 - 60.0,03 + 71.0,03 = 10,33g.

Chọn A.
A. Sai, chỉ thu được tối đa 2 ancol.
B. Đúng, theo SGK lớp 12.
C. Đúng vì chỉ có thể tạo ra ete CH3 - O - CH3.
D. Đúng, vì có các nhóm - OH kề nhau.

Al2O3+2NaOH+3H2O-->2Na[Al(OH)4]
=> nOH-=2nAl2O3=0,12
ở anot : 2Cl- - 2e -->Cl2
ở catot : Cu2+ +2e --> Cu 2H2O + 2e ---> 2OH- + H2
Bảo toàn e : nCu2+ = 1/2(2nCl2 - nOH-) = 0,09.2-0,06.2=0,03
=> m = 0,03.160 + 0,09.2.58.5=15,33g
=> Đáp án A


| GIẢI THÍCH THÊM |
| + Vì dung dịch sau điện phân có kahr năng tác dụng với Al2O3 nên sẽ có hai trường hợp xảy ra + Trường hợp 1: Dung dịch sau điện phân chứa axit + Trường hợp 2: Dung dịch sau điện phân chứ kiềm |
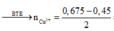


Chọn A
Vì: nkhí = 4,48 : 22,4 = 0,2 (mol); nAl2O3 = 15,3 : 102 = 0,15 (mol)
Có thể xảy ra:
Catot:
(1) Cu2+ + 2e → Cu
(2)2H2O + 2e → 2OH- + H2↑
Anốt
(3) Cl- → Cl2 + 2e
(4) 2H2O → 4H+ + O2 + 4e
Vì Al2O3 có thể bị hòa tan bởi OH- hoặc H+ nên có thể xảy ra 2 trường hợp sau:
TH1: Bên anot nước bị điện phân trước, không có (2) xảy ra.
Al2O3 + 6H+ → 2Al3+ + 3H2O
0,15→ 0,9 (mol)
=> nO2 = 1/4nH+ = 0,225 (mol) > 0,2 mol khí => loại
TH2: Bên catot nước bị điện phân trước, không có (4)
=> nCl2 = nkhí = 0,2 (mol) => ne trao đổi = 2nCl2 = 0,4 (mol)
Al2O3 + 2OH- → 2AlO2- + 2H2O
0,15→ 0,3 (mol)
=> nCu2+ = (0,4 – 0,3)/ 2 = 0,05 (mol)
=> m = mCuSO4 + mKCl = 0,05. 160 + 0,4. 74,5 = 37,8 (g)