Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Phản ứng điện phân xảy ra ở các điện cực như sau:
Catot(-): Cu2+ + 2e → Cu; 2H2O + 2e → H2 + 2OH-; Anot(+): 2Cl- - 2e → Cl2
P.ư trung hòa: H+ + OH- → H2O ; Ag+ + Cl- → AgCl↓
nCl2 = 3,36/22,4 = 0,15 mol; nAgCl = 2,87/143,5 = 0,02 mol → nCl- = 2nCl2 + nAgCl = 0,32 mol; nHNO3 = 0,1 mol = nOH-; Áp dụng định luật bảo toàn điện tích → 2nCu2+ + nOH- = 2nCl2 → nCu2+ = 0,1 mol → [CuCl2] = 0,1/0,4 = 0,25M; [KCl] = 0,12/0,4 = 0,3M.

Bảo toàn Na: mol NaOH=2*mol Na2CO3 = 0.06
Bảo toàn khối lượng ==> mH2O = 2,76 + 40*0,06 - 4,44 = 0,72 ==> mol H2O = 0,04
CxHyOz + NaOH ---> muối CxHy-1O2Na + H2O (1)
----a--------0,06----------------------------------0,04
muối CxHy-1O2Na + O2 ----> CO2 + H2O + Na2CO3 (2)
------------------------------------0,11---0,05-----0,03
(1)+(2): CxHyO2Na + NaOH + O2 ----> CO2 + H2O + Na2CO3 (2)
-----------------a------------------------------0,11---0,09-----0,03
mol H: ay + 0,06 = 2*0.09 = 0,18 ===> ay = 0,12
Khi A cháy ==> mol H2O = 0,5ay = 0,06 ==> m H2O = 1,08
Theo bài ra, thu được 4,44g 2 muối + nước
\(\Rightarrow\) 2 x 76 + 0,06 x 40 = 4,44 + m(g) nước
A = CxHyO2
nC = 0,14mol; nH = 0,1 + 0,04 − 0,06 = 0,08
nO = \(\frac{2\times76-m_C-m_H}{16}\) = 0,06
\(\Rightarrow\) Công thức phân tử: C7H6O3.
Đốt cháy thu \(n_{H_2O}\) = 0,02 x 3 = 0,06 mol \(\Rightarrow\) \(m_{H_2O}\) = 0,06 x 18 = 1,08 gam.

Phản ứng điện phân xảy ra ở các điện cực như sau:
Catot(-): Cu2+ + 2e → Cu; Anot(+): 2Cl- - 2e → Cl2.
Để dung dịch sau điện phân làm dung dịch phenolphtalein chuyển sang màu hồng thì môi trường của dd phải là môi trường bazơ, tức là H2O đã bị điện phân ở Catot và chưa bị điện phân ở Anot. 2H2O + 2e → H2 + 2OH- . Mà số mol e ở Catot = số mol e ở Anot → 2a + nH2O = b → b > 2a.
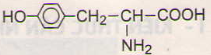 với các chất sau:
với các chất sau:
Đáp án D:
Vì dung dịch sau điện phân hòa tan được Fe3O4 nên dung dịch sau điện phân có chứa H+.
Thứ tự các phản ứng xảy ra như sau:
Các bạn có thể viết các phương trình phản ứng như trên để dễ hiểu quá trình phản ứng và tính toán theo yêu cầu đề bài. Tuy nhiên, các bạn có thể rút ngắn quá trình tính toán mà không cần viết phương trình phản ứng như sau:
Ta có các bán phản ứng: