Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A.
Khí thoát ra tại anot gồm Cl2 (0,15 mol)
và O2 (a mol).
![]()
Þ mdd giảm =
64.(0,15 + 2a) + 71.0,15 + 32a = 28,25
Þ a = 0,05.
Dung dịch X gồm NaNO3, HNO3
(4a = 0,2 mol) và Cu(NO3)2 dư (x – 0,25 mol).
Khi cho Fe vào dung dịch X thì:
3Fe + 8HNO3 ® 3Fe(NO3)2 + 2NO + 4H2O ,
![]()
Fe + Cu(NO3)2 ® Fe(NO3)2 + Cu (2) , Dmtăng (2) = (64 – 56).(x – 0,25) = 8x – 2 (g)
Theo đề: 4,2 – (8x – 2) = 3 Þ x = 0,4

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Chọn C.
Ta có: ne = 0,12 mol ® Tại anot có khí Cl2 (x mol) và O2 (y mol) và tại catot có Cu (0,06 mol).
mà mdd giảm = 71x + 32y + 0,06.64 = 6,45 và 2x + 4y = 0,12 Þ x = 0,03 ; y = 0,015.
Dung dịch Y có chứa H2SO4 (0,015.2 = 0,03 mol) ; Na2SO4 (0,03 mol).
Khi cho 0,05 mol Fe(NO3)2 vào Y thì:
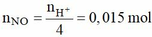
Dung dịch Z chứa Fen+ (0,05), Na+ (0,06), SO42- (0,06), NO3- (0,1 – 0,015 = 0,085) Þ m = 15,21 (g)





 với các chất sau:
với các chất sau:


