Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Số mol khí thoát ra bằng 0 , 336 22 , 4 = 0,015 (mol) nên số mol e trao đổi bằng 0,015.4 = 0,06 (mol)
Đặt n Ag 2 SO 4 = x ( mol ) n CuSO 4 = y ( mol )
Cu2+ + 2e ⟶ Cu
y ⟶ 2y ⟶ y
Ag+ + e ⟶ Ag
2x ⟶ 2x ⟶ 2x
Khối lượng catot tăng thêm chính là tổng khối lượng Ag và Cu nên có hệ:
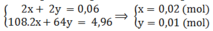
Khối lượng kim loại bám ở catot lần lượt là: 0,02.2.108 = 4,32 (g) và 0,01.64 = 0,64 (g).

Đáp án A
Thứ tự các phản ứng điện phân xảy ra:
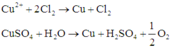
Do đó kim loại bám vào catot là Cu, khí thoát ra ở anot là Cl2, có thể có O2.
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
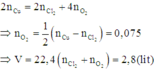

Vi la KL kiem nen PU la : RCl ---> R + 1/2 Cl2 , ncl2 =0.08 mol => n kl = 2*0.08= 0.16mol
M(kimloai) = 6.24/ 0.16 = 39 => kimloai la Kali Chon C

Đáp án D
- Phương trình điện phân:
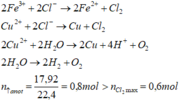
Chứng tỏ anot đã có O2 thoát ra
⇒ n O 2 = 0 , 8 - 0 , 6 = 0 , 2 mol Có 2 n Cl 2 + 4 n O 2 = 2 . 0 , 6 + 4 . 0 , 2 > 0 , 4 + 2 . 0 , 6 = n Fe 3 + + 2 n Cu 2 +
=> Chứng tỏ Cu2+ đã bị điện phân hết, ở catot H+ đã bị điện phân (H+ sinh ra ở anot, di chuyển về catot)
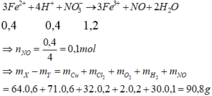
Gần với giá trị 91 nhất

Chọn A.
Tại anot có khí Cl2 và O2 thoát ra với
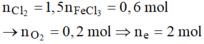
Tại catot lúc này có:
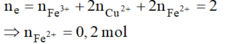
Dung dịch còn lại sau khi lấy catot ra khỏi bình điện phân chứa Fe2+ dư (0,2 mol); H+ (0,8 mol); NO3– (1,2 mol), lúc này tiếp tục xảy ra phản ứng oxi hóa khử nên n H + dư = 0,8 – 4 3 n F e 2 + = 8/15 mol
Dung dịch Y chứa Fe3+ (0,2 mol); H+ dư (8/15 mol) và NO3– (1,2 mol). Vậy ( m Y - m X = 9 , 67 )

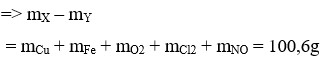
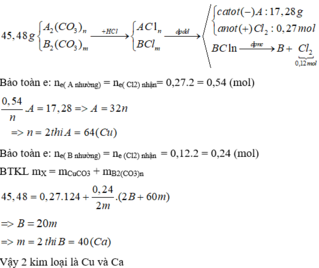


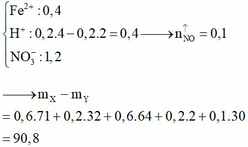

Đáp án B
mO = 28,168 – 18,536 = 9,632g => nO = 0,602 => ne = 1,204
=> m = 18,536 + 62.1,204 = 93,184