Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A.
Tại anot có khí Cl2 và O2 thoát ra với
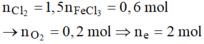
Tại catot lúc này có:
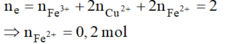
Dung dịch còn lại sau khi lấy catot ra khỏi bình điện phân chứa Fe2+ dư (0,2 mol); H+ (0,8 mol); NO3– (1,2 mol), lúc này tiếp tục xảy ra phản ứng oxi hóa khử nên n H + dư = 0,8 – 4 3 n F e 2 + = 8/15 mol
Dung dịch Y chứa Fe3+ (0,2 mol); H+ dư (8/15 mol) và NO3– (1,2 mol). Vậy ( m Y - m X = 9 , 67 )

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất

Áp dụng định luật bảo toàn khối lượng ta có:
\(m=m_{ACl_n}+m_{BCl_m}=m_{A+B}+m_{HCl}-m_{H_2}\)
Áp dụng bảo toàn nguyên tố:
nHCl phản ứng = 2nH2 = 0,2 mol
Ta có m = 10 + 0,2 x 36,5 - 0,2 = 17,1 (g)
Chọn đáp án B

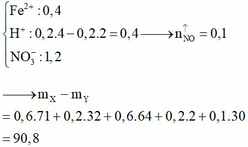

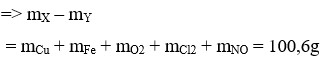
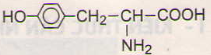 với các chất sau:
với các chất sau:
Đáp án D
- Phương trình điện phân:
Chứng tỏ anot đã có O2 thoát ra
⇒ n O 2 = 0 , 8 - 0 , 6 = 0 , 2 mol Có 2 n Cl 2 + 4 n O 2 = 2 . 0 , 6 + 4 . 0 , 2 > 0 , 4 + 2 . 0 , 6 = n Fe 3 + + 2 n Cu 2 +
=> Chứng tỏ Cu2+ đã bị điện phân hết, ở catot H+ đã bị điện phân (H+ sinh ra ở anot, di chuyển về catot)
Gần với giá trị 91 nhất