Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Fe(OH)3, Mg(OH)2 là a,b (mol)
PTHH: \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H2O\)
________a ------------> 0,5a____________(mol)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b-----------------> b_________(mol)
=> \(\left\{{}\begin{matrix}107a+58b=27,2\\160.0,5a+40b=27,2-7,2\end{matrix}\right.\) => \(\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,11\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Fe\left(OH\right)_3}=0,2.107=21,4\\m_{Mg\left(OH\right)_2}=0,1.58=5,8\left(g\right)\\m_{Fe_2O_3}=160.0,5.0,2=16g\\m_{MgO}=40.0,1=4\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Fe\left(OH\right)_3}=\frac{21,4}{27,2}.100\%=78,68\%\\\%m_{Mg\left(OH\right)_2}=\frac{5,8}{27,2}.100\%=21,32\%\end{matrix}\right.\)

\(a/Fe_2O_3+3CO\xrightarrow[]{t^0}2Fe+3CO_2\\ MgO+CO\xrightarrow[]{t^0}Mg+CO_2\\ Al_2O_3+3CO\xrightarrow[]{t^0}2Al+3CO_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(b/n_{HCl}=0,1.1=0,1mol\\ n_{Fe_2O_3}=a\\ n_{MgO}=n_{Mg}=b\\ n_{Al_2O_3}=c\\ n_{Fe}=2a\\ \Rightarrow\left\{{}\begin{matrix}160a+40b+102c=2,22\\56a+24b+27c=1,98\\2.2a+2b+6c=0,1\end{matrix}\right.\\ \Rightarrow a=\)
đến đây số mol ra âm bạn coi lại đề nhé

a) Đặt a=nMg(OH)2 ; b=nFe(OH)3 (a,b>0)
PTHH: Mg(OH)2 -to-> MgO + H2O
a______________a(mol)
2 Fe(OH)3 -to-> Fe2O3 +3 H2O
b_________0,5b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}58a+107b=165\\40a+80b=165-45=120\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=1\\b=1\end{matrix}\right.\)
=> mMg(OH)=1.58=58(g)
=>%mMg(OH)2= (58/165).100=35,152%
=>%mFe(OH)3= 64,848%
b) PTHH: Fe(OH)3 + 3 HCl -> FeCl3 + 3 H2O
1_______________3(mol)
Mg(OH)2 + 2 HCl -> MgCl2 + H2O
1_______2(mol)
=> mHCl=(2+3).36,5= 182,5(g)
=> mddHCl= (182,5.100)/14,6=1250(g)
=> VddHCl= 1250/1,15= 1086,957(ml)
a) Khối lượng hỗn hợp giảm là khối lượng nước thoát ra
Mg(OH)2 -----to-------> MgO + H2O
x mol ------------------>x------->x (mol)
2Fe(OH)3 ------to----------> Fe2O3 + 3H2O
y mol -----------------------> y/2------->3/2y (mol)
Ta có:\(\left\{{}\begin{matrix}58x+107y=165\\x+\dfrac{3}{2}y=\dfrac{45}{18}=2,5\end{matrix}\right.\)
=> x = 1 và y = 1
=> mMg(OH)2 = 58g và mFe(OH)3 = 107 g
=> %mMg(OH)2 = \(\dfrac{58}{165}.100\) = 35,15%
=> %mFe(OH)3 = 64,85%
b) Y là MgO (1 mol) và Fe2O3 ( 0,5 mol)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
1--------->2 (mol)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
0,5-------->3 (mol)
=> \(m_{HCl}=\left(2+6\right).36,5=292\left(g\right)\)
=>\(m_{ddHCl}=\dfrac{292}{14,6\%}=2000\left(g\right)\)
=> \(V_{ddHCl}=\dfrac{m}{D}=\dfrac{2000}{1,15}=1739,13\left(ml\right)\)

Ta có: nMgCl2=0,15.1=0,15 mol
mNaOH=80.20%=16 gam\(\rightarrow\) nNaOH=\(\frac{16}{40}\)=0,4 mol
Phản ứng:
MgCl2 + 2 NaOH \(\rightarrow\) Mg(OH)2 + 2NaCl
Vì nNaOH > 2nMgCl2 nên NaOH dư
\(\rightarrow\) nMg(OH)2=nMgCl2=0,15 mol
Nung kết tủa đến khối lượng không đổi
Mg(OH)2\(\rightarrow\) MgO + H2O
\(\rightarrow\)nMgO =nMg(OH)2=0,15 mol\(\rightarrow\)mMgO=0,15.40=6 gam

a. Các phương trình có thể xảy ra:
C + O2 → t ∘ CO2 (1)
CaCO3 → t ∘ CaO + CO2 (2)
MgCO3 → t ∘ MgO + CO2 (3)
CuCO3 → t ∘ CuO + CO2 (4)
C +CO2 → t ∘ 2CO (5)
C + 2CuO → t ∘ 2Cu + CO2 (6)
CO + CuO → t ∘ Cu + CO2 (7)
CaO + 2HCl →CaCl2 + H2O (8)
MgO + 2HCl →MgCl2 + H2O (9)
CuO + 2HCl →CuCl2 + H2O (10)
b. Vì sau phản ứng có CO và CO2, các phản ứng xảy ra hoàn toàn nên các chất còn lại sau khi nung là CaO, MgO và Cu không có phản ứng (10)
mCu = 3,2(g) => mCuCO3 = 6,2g
Gọi số mol CaCO3, MgCO3, C trong hỗn hợp lần lượt là a, b, c.(*)
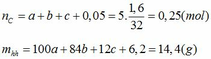
Giải ( *), (**), (***) ta được a=0,025; b=0,05; c=0,125.
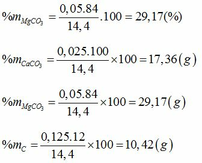
- PTHH: 2Al(OH)3\(\underrightarrow{t^0}\)Al2O3+3H2O
Zn(OH)2\(\underrightarrow{t^0}\)ZnO+H2O
- Khối lượng chất rắn giảm chính là khối lượng nước tạo thành
\(\rightarrow\)\(n_{H_2O}=\dfrac{m}{M}=\dfrac{1,98}{18}=0,11mol\)
- Gọi số mol Al(OH)3 là x và Zn(OH)2 là y ta có hệ phương trình:
\(\left\{{}\begin{matrix}78x+99y=6,66\\\dfrac{3x}{2}+y=0,11\end{matrix}\right.\)
- Giải ra x=0,06 và y=0,02
- Thành phần phần trăm khối lượng mỗi hidroxit là:
\(\%m_{Al\left(OH\right)_3}=\dfrac{0,06.78.100}{6,66}\simeq70,27\%\)
\(\%m_{Zn\left(OH\right)_2}=100\%-70,27\%=29,73\%\)