
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

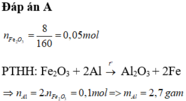

a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)

Gọi a là số mol của lá nhôm tham gia p/ứ:
PTHH:
2Al + 3 CuSO4 \(\rightarrow\)Al(SO4)3 + 3 Cu
a mol\(\rightarrow\)\(\frac{3}{2}\)a mol \(\rightarrow\) \(\frac{3}{2}\)a mol
Theo đề bài cho độ tăng KL của lá nhôm sau p/ứ là:
mCu bám - mal tan = \(\frac{3}{2}\)62a - 27a= 1,38
\(\Rightarrow\)a= 0,02 mol
a) Khối lượng nhôm tham gia phản ứng:
m= n x M = 0,02 x 27 = 0,54 g
b) Khối lượng đồng sunfat trong dung dịch
m = n x M = \(\frac{3}{2}\)0,02 x 160= 4,8 g

Hỗn hợp A gồm 0,56 g Fe và 16 g Fe2O3.Trộn A với m gam bột nhôm rồi nungở nhiệt độ cao (không có không khí), thu được hỗn hợp D. Nếu cho D tan trong dung dịch H2SO4loãng dư thì thu được a lít khí, nhưng cho D tác dụng với dung dịch NaOH (dư) thì thể tích khí thu được là 0,25a lít (trong cùng điều kiện). Khoảng giá trị của m là
A. 0,54 < m < 2,70. B. 2,7 < m < 5,4.
C. 0,06 < m < 6,66. D. 0,06 < m < 5,4.
nFe = 0.01
nFe2O3 = 0.1
Gọi hiệu suất pứ nhiệt nhôm là h ( 0 < h < 1 )
h = 0
=> Al chưa pứ
nH2 do Fe sinh ra = (a - 0.25a)/22.4 = 0.01
=> a = 112/375
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => m = 0.06
h =1 :
Al dư,Fe2O3 hết
nAl pứ = 2nFe2O3 = 0.2
=> nFe = 0.1*2 + 0.01 = 0.21
nH2 do fe sinh ra = (a - 0.25a)/22.4 = 0.21
=> a = 6.272
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => nAl ban dầu = 5a/672 + 0.2 = 0.74/3
=> m = 6.66g
=> C 0,06 < m < 6,66

Thành phần chính của thuốc muối là natri hiđrôcacbonat, CTHH: NaHCO3. Trong dạ dày thường chứa dung dịch axit. Người bị đau dạ dày là người có nồng độ dung dịch axit HCl cao làm dạ dày bị bào mòn. NaHCO3 dùng để làm thuốc trị đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ có phản ứng hóa học.
NaHCO3 + HCl → NaCl + CO2 + H2O
Thành phần chính của thuốc muối nabica là natri hidrocacbonat (NaHCO3).
Cơ chế hoạt động của thuốc: Trong dạ dày có 1 lượng axit HCl giúp hòa tan các loại muối khó tan trong quá trình ăn uống. Khi axit dạ dày tăng cao, nếu uống thuốc muối nabica thì NaHCO3 trong thuốc muối tác dụng với axit HCl trong dạ dày theo phương trình hóa học:
NaHCO3 + HCl \(\rightarrow\) NaCl + CO2\(\uparrow\) + H2O.
Lượng axit thừa trong dạ dày đã tác dụng với NaHCO3 có trong thuốc muối nabica, do vậy không còn, nhờ vậy người bị ợ chua, thừa axit không còn bị như vậy nữa.

a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
Giải
a) Gọi CTHH của oxit sắt là: FexOy
PTHH: : FexOy + yCO ------> xFe + yCO2
Số mol Fe là

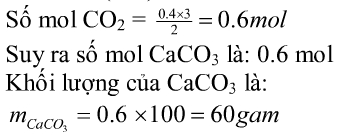
a/
mFe=22,4g
=> mO = 32-22,4=9,6g
Gọi công thức oxit sắt: FexOy
x:y=(22,4:56):(9,6:16)=2:3
=> CT: Fe2O3.
b/
nO=nC=nCO2=(9,6:16)=0,6mol
nCaCO3 =nCO2=0,6mol
=> mCaCO3 =0,6.100=60g

Bài 1 :
nFe = 0,25 mol; nAgNO3 = 0,2 mol; nCu(NO3)2 = 0,05 mol.
Giữa Ag+ và Cu2+ thì Ag+ có tính oxi hóa mạnh hơn Cu2+, nên Ag+ tham gia phản ứng với Fe trước, sau khi Ag+ tham gia phản ứng hết nếu còn dư Fe thì Cu2+ mới tiếp tục tham gia.
Fe + 2Ag+ → Fe2+ + 2Ag (VII)
nFe = 0,25 mol; nAg+ = 0,2 mol → Fe dư sau phản ứng (VII)
Fe + 2Ag+ → Fe2+ +2Ag
0,1 (mol) 0,2 (mol) 0,1 (mol) 0,2 (mol)
Sau phản ứng (VII) ta có: nFe còn = 0,25 – 0,1 = 0,15 mol, Ag tạo thành = 0,2 mol.
Fe + Cu2+ → Fe2+ + Cu (VIII)
nFe = 0,15 mol; nCu2+ = 0,05 mol → Fe vẫn còn dư sau phản ứng (VIII)
Fe + Cu2+ → Fe2+ + Cu
0,05 (mol) 0,05 (mol) 0,05 (mol) 0,05 (mol)
Vậy, sau phản ứng (VII) và (VIII), chất rắn thu được gồm nAg = 0,2 mol; nCu = 0,05 mol và nFe dư = 0,25 – (0,1 + 0,05) = 0,1 mol.
Nên ta có giá trị của m = mAg + mCu + mFe dư
= 0,2.108 + 0,05.64 + 0,1.56 = 30,4 gam.
Bài 2 :
Nhận xét :
- Mg sẽ tác dụng với AgNO3 trước, sau khi AgNO3 hết thì Mg mới phản ứng với Cu(NO3)2.
- Vì chưa biết khối lượng Mg tham gia là bao nhiêu, nên bài toán này ta phải chia ra các trường hợp:
+ Mg tham gia vừa đủ với AgNO3, Cu(NO3)2 chưa tham gia, chất rắn thu được là Ag tính được giá trị m1.
+ AgNO3, Cu(NO3)2 tham gia hết, Mg phản ứng vừa đủ, chất rắn tham gia gồm Ag, Cu có giá trị là m2.
Nếu khối lượng chất rắn trong 2 trường hợp nằm trong khoảng m1< 17,2 < m2 (từ dữ kiện đề bài, tính toán giá trị m1, m2) có nghĩa là Ag+ tham gia phản ứng hết, Cu2+ tham gia một phần.
Đáp số : m = 3,6gam.

a. PTHH: \(2SO_2+O_2\rightarrow^{t^o}_{V_2O_5}2SO_3\) (đoạn này Latex OLM đánh nhiều hơi rối nên không hiểu thì hỏi nhé)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(300ml=0,3l\)
\(\rightarrow n_{H_2SO_4}=1.0,3=0,3mol\)
Theo phương trình \(n_{O_2}=n_{SO_3}=n_{H_2SO_4}=0,3mol\)
\(\rightarrow m_{SO_2}=64.0,3=19,2g\)
b. PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(n_{Al_2O_3}=\frac{15,3}{102}=0,15mol\)
Xét tỉ lệ \(n_{Al_2O_3}>\frac{n_{H_2SO_4}}{3}\)
Vậy \(Al_2O_3\) dư
Theo phương trình \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{3}n_{H_2SO_4}=0,1mol\)
\(\rightarrow C_{M_{Al_2\left(SO_4\right)_3}}=\frac{0,1}{0,3}=0,33M\)

Vừa qua nó bị lỗi dòng, cô gửi lại nhé:
Dòng chứa tất cả các chất axit là dòng D.
\(H_3BO_3-\text{Axit boric}\)
\(H_2SO_4-\text{Axit sunfuric}\)
\(H_2SO_3-\text{Axit sunfurơ}\)
\(HCl-\text{Axit clohiđric}\)
\(HNO_3-\text{Axit nitric}\)